Charakteristika kovů s2 a jejich porovnání s kovy s1
Skupina II.A
Beryllium (Be), hořčík (Mg), vápník (Ca), stroncium (Sr), baryum (Ba), radium (Ra)
Prvky Ca, Sr, Ba, Ra jsou označovány triviálním názvem kovy alkalických zemin.
Beryllium a hořčík se svými vlastnostmi liší od ostatních prvků této skupiny, proto nejsou řazeny do skupiny kovy alkalických zemin, ale jen mezi kovy II.A skupiny. Odlišnost vlastností se projevuje i v praktickém uplatnění:
- Beryllium a hořčík tvoří s jinými kovy technicky velmi významné slitiny.
- Kovy alkalických zemin ve formě kovu širší praktické uplatnění nemají, velmi důležité jsou však jejich sloučeniny.
Porovnání vlastností kovů II.A s kovy I.A
-
Kovy skupiny II.A jsou stříbrolesklé podobně jako kovy I.A.

- Ve valenčních orbitalech ns mají dva elektrony. Konfigurace valenčních elektronů: ns2; n = 2 .. 7.
-
Mají menší atomové poloměry než prvky I.A skupiny, a proto
-
mají výrazně vyšší teploty tání a varu,
(Teplota tání u kovů závisí na více faktorech, především na velikosti poloměru iontů, tvořících krystalovou mřížku, typu krystalové struktury a u přechodných kovů na počtu a uspořádání valenčních elektronů. Alkalické kovy krystalují v krychlové tělesně centrované mřížce. Kovy s2 s výjimkou barya krystalují v odlišných krystalických mřížkách. Hořčík má nižší teplotu tání než kovy alkalických zemin, krystaluje v soustavě hexagonální, oproti tomu vápník a stroncium mají krychlovou plošně centrovanou krystalovou mřížku a baryum krychlovou tělesně centrovanou mřížku. Beryllium krystaluje stejně jako hořčík v hexagonální soustavě, ovšem jeho atomový poloměr 105 pm je asi o třetinu menší než poloměr hořčíku – 160 pm.)
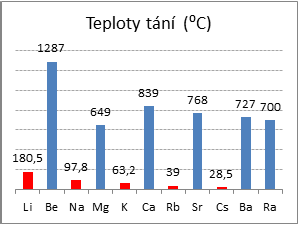
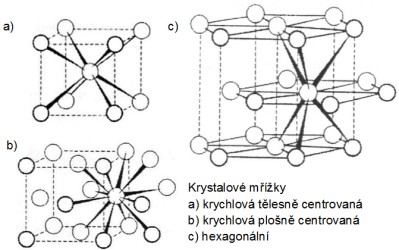
Obr. 1: Porovnání teplot tání kovů s1 a s2 Obr. 2: Krystalové mřížky kovů -
jsou tvrdší a křehčí než prvky I.A skupiny,
-
mají vyšší hustotu,
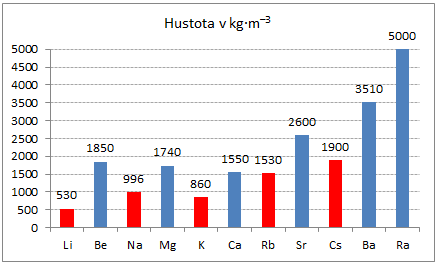
Obr. 3: Porovnání hustot kovů I.A a II.A skupiny -
mají vyšší hodnoty ionizačních energií než kovy I.A,
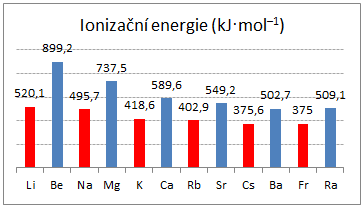
Obr. 4: Porovnání hodnot ionizačních energií kovů I.A a II.A -
z porovnání ionizačních energií plyne, že kovy II.A jsou méně reaktivní než kovy I.A,
-
-
Ve skupině II.A
-
roste s protonovým číslem zásaditost oxidů a hydroxidů,
Be(OH)2 je amfoterní – reaguje se zásadami i kyselinami:– se zásadou: Be(OH)2 + 2 NaOH → Na2[Be(OH)4] tetrahydroxoberyllnatan disodný – s kyselinou: Be(OH)2 + 2 HCl → BeCl2 + 2 H2O chlorid beryllnatý Mg(OH)2 je slabě zásaditý Ca(OH)2, Sr(OH)2, Ba(OH)2 jsou silné zásady -
roste rozpustnost hydroxidů ve vodě,
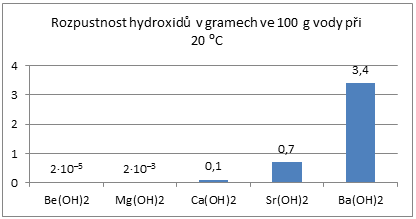
Obr. 5: Rozpustnost hydroxidů kovů II.A ve skupině vzrůstá
- klesá však rozpustnost síranů a uhličitanů.
Víme již, že síran barnatý je velmi nerozpustný ve vodě a právě tato vlastnost je významná při jeho využití v medicíně.
-
-
Ionty kovů alkalických zemin charakteristicky barví plamen:
|
Obr. 6: Zábavní pyrotechnika |
Ca2+ cihlově červeně |  |
|||
|
Sr2+ karmínově červeně |
 |
||||
|
Ba2+ zeleně |
 |
||||
|
Ra2+ karmínově červeně |
 |
Be2+ a Mg2+ vzhledem ke své malé velikosti neposkytují přechody elektronů a nebarví plamen.
Plamenové zkoušky: podívejte se na video, charakteristické barvy uvidíte až po chvíli hoření směsí, standardně se tyto zkoušky totiž provádějí v nesvítivém plameni kahanu.

