Izomerie
U čtvrtého členu homologické řady alkanů – butanu – se můžeme setkat s jevem, který se nazývá řetězová izomerie. Řetězové izomery patří mezi izomery konstituční, neboť se od sebe liší konstitucí (různým uspořádáním atomů).
Znázorněme si řetězové izomery molekulového vzorce C4H10 a C5H12:
Tab. 1: Řetězové izomery molekulového vzorce C4H10
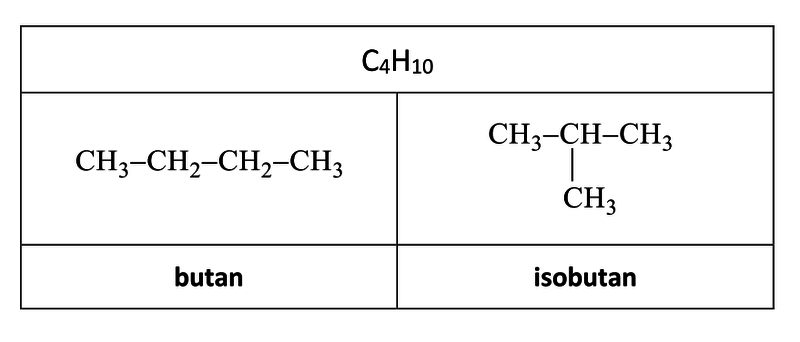
Alkan C4H10 tvoří 2 řetězové izomery (butan, methylpropan).
Tab. 2: Řetězové izomery molekulového vzorce C5H12
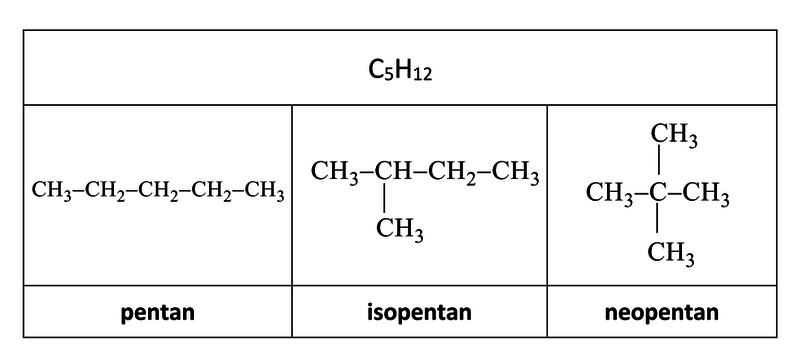
Počet řetězových izomerů alkanů se v homologické řadě prudce zvyšuje.
Alkan C6H14 tvoří 5 izomerů, C7H16 9 izomerů, C8H18 18 izomerů, C9H20 35 izomerů, C20H42 366 319 izomerů a alkan C60H122 2,2.1022 řetězových izomerů.
Konformace alkanů
Studiem energetického obsahu (a tedy pravděpodobnosti existence) molekul uhlovodíků chemici zjistili, že kolem jednoduchých sigma vazeb v molekulách může docházet k tzv. vnitřní rotaci. Při ní mohou části molekul, touto vazbou spojené, zaujímat vůči sobě rozdílnou polohu. Tato prostorová uspořádání, která lze ztotožnit zmíněnou rotací, se nazývají konformace.
Důsledkem otáčení kolem jednoduché vazby je přibližování a oddalování atomů a skupin atomů v molekule, čímž se zvyšuje nebo snižuje možnost jejich vzájemného ovlivňování. Toto vzájemné ovlivňování může nabýt charakteru přitažlivých nebo odpudivých sil.
Platí, že čím dále od sebe atomy nebo skupiny atomů jsou, tím menší je jejich vzájemné ovlivňování a tím energeticky výhodnější je toto uspořádání.
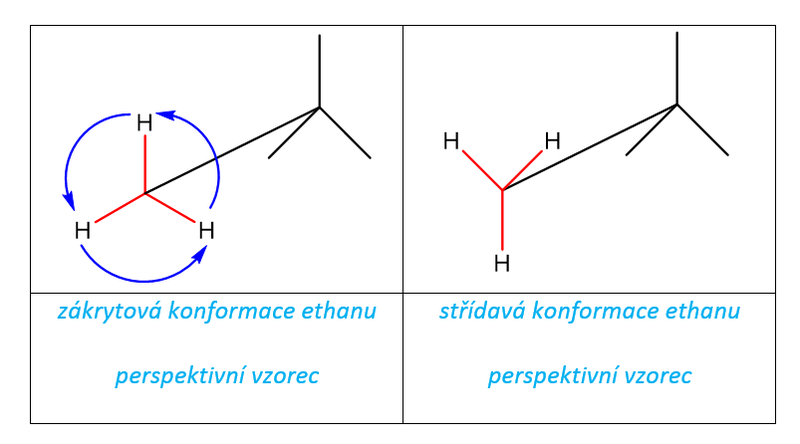
Například v ethanu dochází pootočením okolo vazby C-C o 60° ke vzniku dvou odlišných konformačních struktur, které nazýváme „zákrytová“ (synperiplanární nebo zkráceně syn-) a „střídavá“ (antiperiplanární nebo zkráceně anti-). V případě ethanu je střídavá konformace energeticky výhodnější, protože všechny atomy jsou od sebe maximálně vzdáleny. Pro znázornění konformací molekul se používají perspektivní a projekční vzorce:
Tab. 3: Konformace ethanu
Tab. 4: Projekční vzorce ethanu
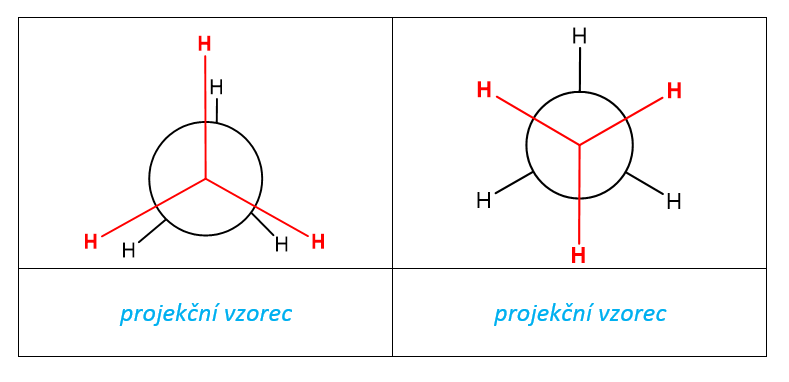
Za pokojové teploty není možné jednotlivé konformery ethanu od sebe oddělit, protože tato teplota postačuje k tomu, aby jednotlivé konformery přecházely jeden v druhý. Teprve při dostatečně nízké teplotě (asi 50 K) je rotace dostatečně pomalá a konformery lze od sebe oddělit. Jakmile však oddělené konformery vystavíme vyšší teplotě, dojde k tomu, že začnou opět přecházet jeden v druhý.
Ke stejnému jevu může docházet i v molekule butanu. Pokud dojde k rotaci mezi druhým a třetím uhlíkem, získáme čtyři různé konformace butanu:
-
antiperiplanární – jedna CH3– skupina je nad a druhá pod rovinou,
-
antiklinální – CH3– skupina je v zákrytu s H–,
-
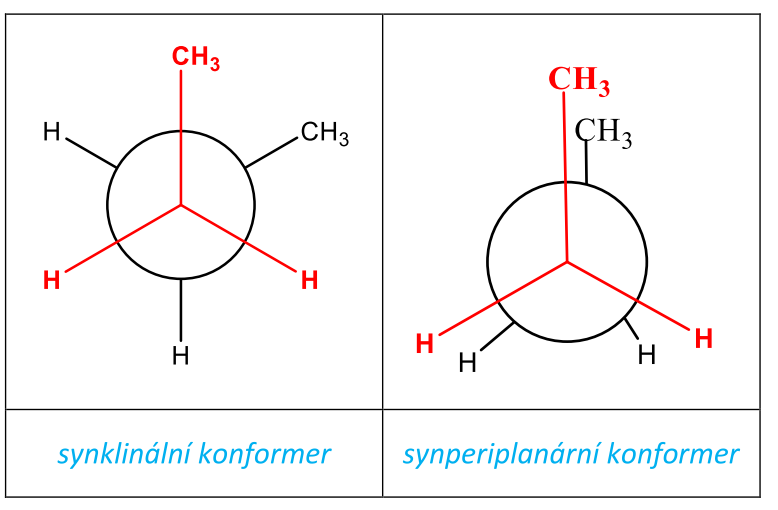
synklinální (gauche) – CH3– skupiny jsou si nejblíže, ale ne v zákrytu,
-
synperiplanární – CH3– skupiny jsou v zákrytu.
Konformery se liší svou energií, nejnižší energii má konformer v antiperiplanárním uspořádání a gauche konformer. Molekula preferuje konformace s nízkou energií. Nejméně stabilní konformací a tedy konformací s nejvyšší energií je synperiplanární konformace butanu.
Tab. 5: Antiperiplanární a antiklinální konformace butanu (projekční vzorce) 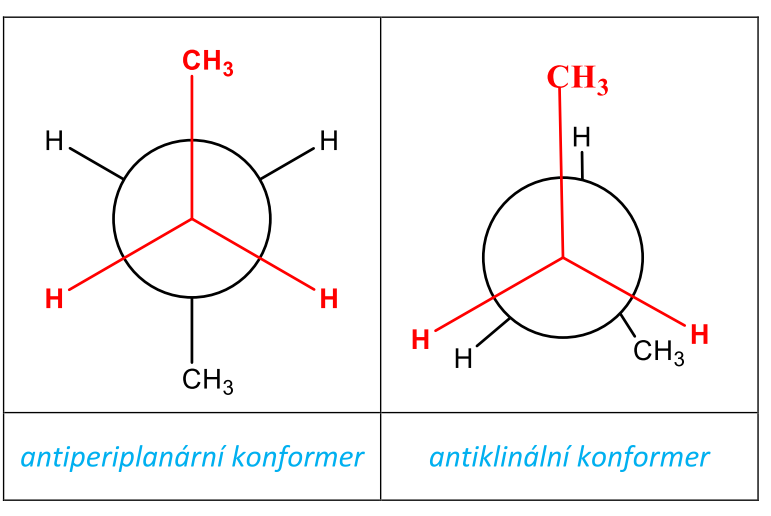
Tab. 6: Synklinální a synperiplanární konformace butanu (projekční vzorce)