Atom uhlíku – jeho struktura a vazebné možnosti
Strukturní teorii organických látek formuloval již v 19. století A. M. Butlerov.
Má tyto základní postuláty:
-
Atom uhlíku je v organických sloučeninách čtyřvazný.
-
Všechny jednoduché vazby uhlíku jsou rovnocenné. Uhlíkové atomy mají schopnost vytvářet stabilní řetězce otevřené i uzavřené a vázat se v nich navzájem vazbami jednoduchými, dvojnými a trojnými.
-
Vlastnosti organických látek závisí nejen na jejich složení, ale také na jejich struktuře.
 |
| Obr. 1: Molekula methanu |
 |
| Obr. 2: Sjednocení orbitalů |
Vazby mezi atomy uhlíku
 |
| Obr. 3: Vazby mezi atomy uhlíku |
| Jednoduchá vazba mezi atomy uhlíku má délku 0,154 nm (1 nm = 10-9 m), označení σ a je rozložena na fiktivní spojnici atomových jader. Čtyři jednoduché vazby kolem atomu uhlíku směřují do vrcholů pravidelného čtyřstěnu, jehož těžištěm je atom uhlíku, a svírají úhel 109o28´. |  |
| Obr. 4: Metan |
 |
Dvojná vazba mezi atomy uhlíku je tvořena jednou vazbou σ a jednou vazbou π, u níž je maximum elektronové hustoty mimo spojnici jader atomů, ale v rovině, která touto spojnicí prochází. Délka dvojné vazby je 0,134 nm, energie není dvojnásobná, jak by se podle názvu dalo očekávat, ale o něco menší než dvojnásobek energie jednoduché vazby. |
| Obr. 5: Ethen |
| Trojná vazba mezi atomy uhlíku je tvořena jednou vazbou σ a dvěma vazbami π, které jsou v rovinách navzájem kolmých a procházejících spojnicí atomových jader. Délka této vazby je 0,120 nm, energie je menší než trojnásobek energie jednoduché vazby mezi atomy uhlíku. |  |
| Obr. 6: Ethyn |
Uhlíkové atomy mají mimořádnou schopnost spojovat se v řetězce nejrozmanitějšího tvaru i délky. Řetězce jsou buď otevřené, v tom případě obsahují na koncích uhlíkové atomy, které spolu nejsou spojeny, nebo jsou uzavřené, a pak jsou jejich uhlíkové atomy spojeny do cyklu neboli kruhu.
 |
| Obr. 7: Uhlovodíkové řetězce |
Vaznost je počet kovalentních vazeb vycházejících z atomu; pro většinu prvků v organických sloučeninách je tento počet stálý.
Nejčastěji vázané atomy v molekulách organických sloučenin:
Vodík jednovazný (1 jednoduchá vazba)
Kyslík dvojvazný (1 násobná (dvojná) vazba nebo 2 jednoduché)
Síra dvojvazná (1 násobná vazba nebo 2 jednoduché)
Dusík trojvazný (1 násobná (trojná) vazba nebo 1 jednoduchá a 1 dvojná nebo 3 jednoduché)
Halogeny jednovazné (1 jednoduchá vazba)
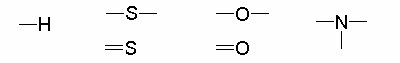 |
| Obr. 8: Vaznost |

