Přehled metod přípravy alkenů
Nenasycené uhlovodíky se připravují eliminačními reakcemi, při nichž se z organické molekuly odštěpuje atom nebo skupina atomů vázaná na jednom uhlíku s atomem (nejčastěji vodíkem) na sousedním uhlíku.
Mezi významné eliminační reakce patří:
-
dehydrogenace,
-
dehydratace,
-
dehydrohalogenace.
1. Dehydrogenace
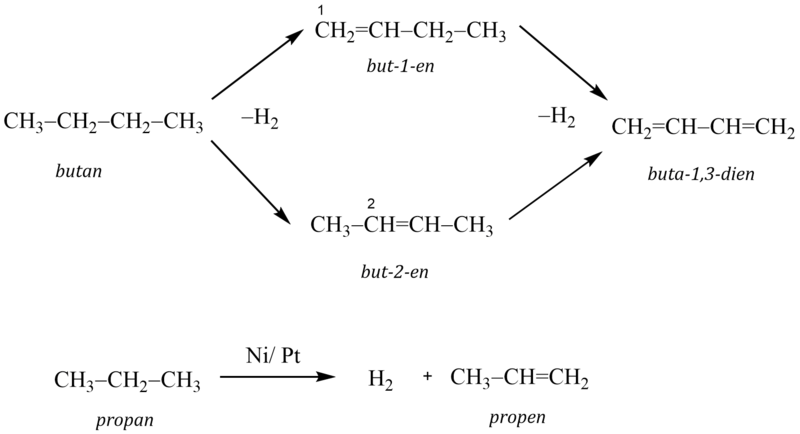
Při dehydrogenaci dochází k odštěpení molekuly vodíku z molekuly alkanu.
Dehydrogenace se provádí účinkem katalyzátorů, nejčastěji směsí oxidu chromitého a oxidu hlinitého nebo niklu či platiny, za zvýšené teploty (od 500 °C do 1000 °C), přičemž vysoká teplota dehydrogenace způsobuje, že mohou probíhat i vedlejší reakce, jako je např. krakování.
Ačkoli se může zdát, že hydrogenace i dehydrogenace jsou urychlovány týmiž katalyzátory, v praxi se pro hydrogenace i dehydrogenace nepoužívá stejných katalyzátorů.
Při hydrogenacích převládá použití kovových katalyzátorů, pro dehydrogenace převažují katalyzátory na bázi oxidů kovů. Příčina spočívá v tom, že dehydrogenace vyžadují poměrně vysokých teplot, při kterých kovové katalyzátory již ztrácejí svoji aktivitu. Proto je nutné použít katalyzátory odolné vůči tepelné deaktivaci i za cenu nižší účinnosti. Dalším důvodem jsou i problémy se selektivitou. Například velmi účinný a téměř univerzální niklový katalyzátor není možné použít při teplotách potřebných pro dehydrogenace, a to proto, že již při teplotách okolo 3000 °C začíná katalyzovat i nežádoucí štěpení vazeb uhlíkatého řetězce.
Příkladem je dehydrogenace butanu, jejímž produktem je směs but-1-enu a but-2-enu. Když tato reakce probíhá dále, vzniká buta-1,3-dien. Dalším příkladem může být dehydrogenace propanu.
2. Dehydrohalogenace
Dehydrohalogenace je eliminační reakce, při které se odštěpuje molekula halogenovodíku z molekuly halogenalkanu. Provádí se působením roztoku hydroxidu draselného v alkoholu. Nejochotněji se odštěpuje jodovodík, následuje bromovodík a chlorovodík.
Při eliminaci halogenovodíku se vodík (proton) vždy odštěpuje z toho atomu uhlíku, který sousedí s uhlíkem nesoucím halogen (který má menší počet atomů vodíku – Zajcevovo pravidlo), přičemž nejsnadněji eliminují halogenovodík terciární alkylhalogenidy, potom sekundární a nejhůře primární alkylhalogenidy.
Příkladem je reakce 2-brombutanu s hydroxidem draselným:

3. Dehydratace
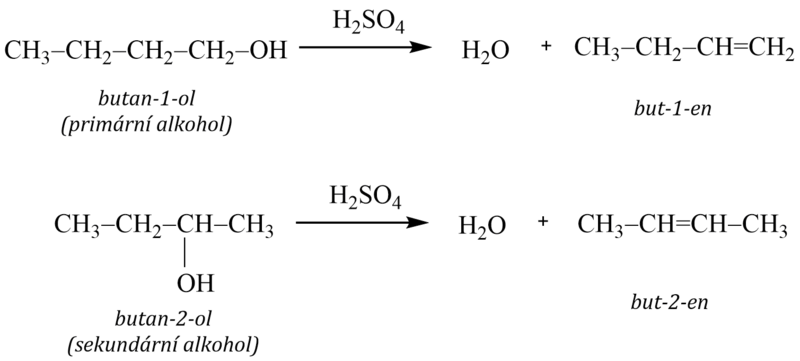
Dehydratace je eliminační reakce, při které dochází k odštěpení vody z molekuly alkoholu.
Provádí se účinkem kyselin, jako je kyselina sírová nebo fosforečná, nebo ji lze uskutečnit také za katalytického působení některých oxidů, např. oxidu hlinitého, za vyšších teplot. I tato eliminace se řídí Zajcevovým pravidlem.
Snadnost dehydratace alkoholů přitom opět klesá od terciárních k primárním alkoholům.
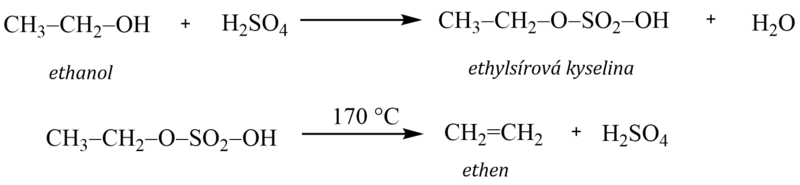
Příkladem je reakce kyseliny sírové s ethanolem. Meziproduktem reakce je kyselina ethylsírová, která se poté rozkládá za teploty okolo 170 °C na ethen, a znovu vzniká kyselina sírová:
Při eliminaci vody z primárních alkoholů vzniká alken s dvojnou vazbou vždy na prvním uhlíku řetězce, zatímco ze sekundárních nebo terciárních alkoholů se odštěpuje hydroxylová skupina a vodík z toho uhlíku, který má nejmenší počet vodíkových atomů.