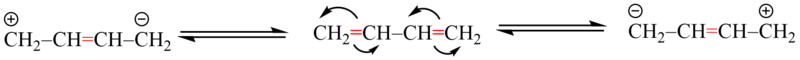Historický úvod
Základním představitelem aromatických uhlovodíků je benzen, sloučenina izolovaná poprvé již v roce 1825 Michaelem Faradayem. Svoje obecné pojmenování získaly aromatické sloučeniny díky faktu, že některé z prvních známých přírodních benzenových derivátů (např. vanilin, skořicová kyselina, anisol) vykazovaly velmi příjemnou a charakteristickou vůni, . Přestože tato charakteristika zdaleka neplatí pro všechny zástupce aromátů, přežil tento obecný název dodnes a koncept aromaticity patří mezi významné pilíře moderní organické chemie.
Struktura benzenu C6H6 byla poprvé navržena v roce 1865 (F. A. Kekulé), kdy byl popsán jako monocyklická molekula se střídajícími se jednoduchými a dvojnými vazbami. I když se tímto způsobem podařilo vysvětlit řadu neobvyklých vlastností benzenu, bylo zřejmé, že tento návrh nemůže být definitivní. Ze strukturní teorie totiž vyplývá, že jednoduchá vazba C–C je delší než vazba dvojná C=C, což vede k formulaci cyklické struktury s rozdílnými vazebnými délkami mezi atomy uhlíku.
Nedostatky Kekulého struktury benzenu vedly k formulaci dalších možných struktur, snažících se vysvětlit chování benzenu (značná stabilita, snadná substituce, neochota k adičním reakcím). Příkladem mohou být snahy Ladenburga (1869) a Dewara (1867), kteří se pokusili popsat strukturu benzenu jako bicyklickou, popř. tetracyklickou.
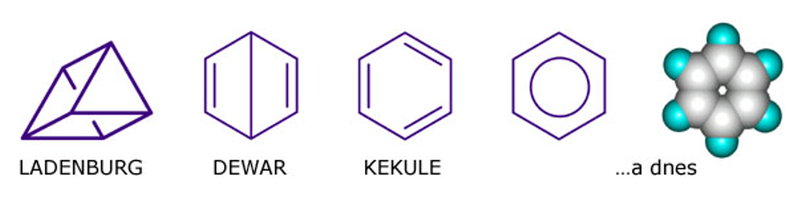
Obr. 1: Historický vývoj struktury benzenu
Dnes je známo, že struktura benzenu je dokonale rovinná a symetrická a že charakter jednoduchých a dvojných vazeb zaniká v důsledku tzv. konjugace. Všechny vazby v benzenu jsou tedy ekvivalentní a psaní jednoduchých a dvojných vazeb se stává formální záležitostí.
Charakteristika
Areny jsou cyklické sloučeniny s delokalizovaným systémem π–elektronů. K delokalizaci dochází v konjugovaných systémech dvojných vazeb.
Jak bylo uvedeno výše, základním aromatickým uhlovodíkem je benzen. Jeho šestičlenný kruh se též nazývá benzenové jádro. Strukturu benzenového jádra jako kruh s konjugovanými dvojnými vazbami navrhl A. Kekulé (1865). Tato představa ale nevystihovala skutečnost, že všechny uhlíky a vazby mezi nimi jsou naprosto rovnocenné. Skutečná struktura byla objasněna až na základě teorie molekulových orbitalů.
U atomů uhlíku v benzenu se uplatňuje hybridizace sp2 (trigonální), kdy všechny vazby C–C a C–H (12 σ–vazeb) leží v rovině a svírají úhel 120°. Čtvrtý elektron je umístěn v nehybridizovaném 2p orbitalu kolmém na rovinu kruhu.
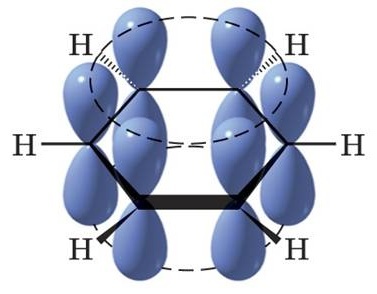
Obr. 2: Šest nehybridizovaných orbitalů 2pz
Překryvem těchto šesti nehybridizovaných orbitalů pz vzniká π–vazba, která je ovšem rovnoměrně sdílena s oběma sousedními rovnocennými 2p orbitaly. Říkáme, že π–elektrony jsou delokalizovány nad a pod rovinou kruhu (σ–vazeb) po celé molekule. Proto mají π–elektrony benzenu (a ostatních arenů) odlišný charakter než π–elektrony alkenů nebo alkynů.
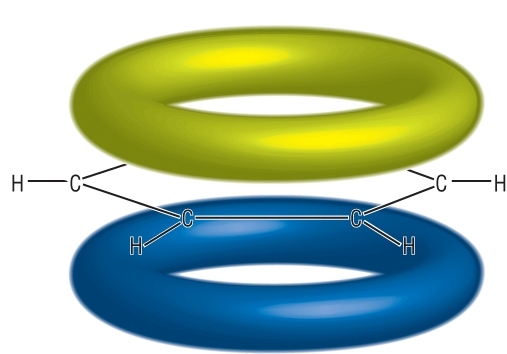
Obr. 3: Delokalizovaný systém π-elektronů nad a pod rovinou kruhu
Skutečná struktura benzenu vypadá tedy tak, že uhlíky v benzenovém jádře jsou spojeny jednoduchými vazbami ( σ –vazby) a šest π–elektronů tvoří delokalizovanou π–vazbu rozprostřenou nad a pod rovinou kruhu. Graficky se struktura benzenu zaznamenává pomocí pravidelného šestiúhelníku s kroužkem uprostřed, který má charakterizovat delokalizovaný systém π–elektronů. Benzen proto nelze považovat za nenasycenou sloučeninu (cyklohexa-1,3,5-trien).
Schematické znázornění molekuly benzenu:
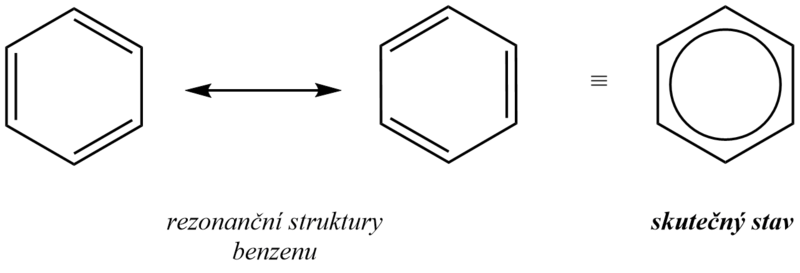
Delokalizace π–elektronů má dva zásadní důsledky:
-
Všechny vazby mezi uhlíkovými atomy jsou rovnocenné, tzn., že elektronová hustota a délka vazby je všude stejná.
-
Delokalizace elektronů způsobuje, že celý systém je významně stabilnější ve srovnání s obdobným systémem majícím lokalizované π–vazby, kdy např. benzen má proti systému s lokalizovanými dvojnými vazbami nižší energii o 151 kJ.mol-1 (delokalizační energie).
Charakteristické znaky aromatických sloučenin
-
Molekula musí být cyklická a rovinná - systém σ–vazeb leží v rovině
-
Delokalizace π–elektronů v kruhu
-
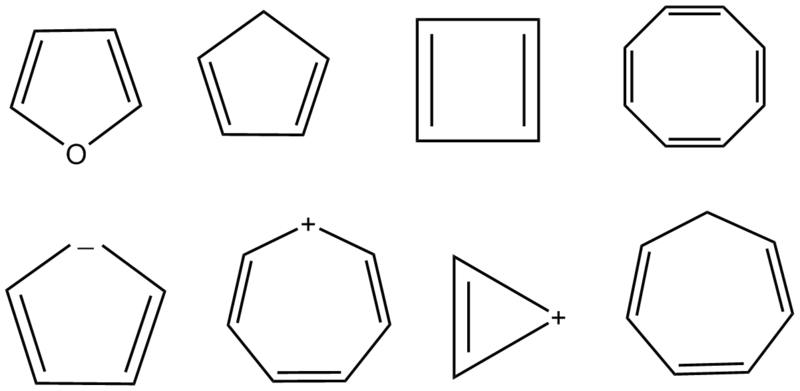
Počet delokalizovaných π–elektronů v kruhu je vždy roven hodnotě 4n + 2, jedná se o tzv. Hückelovo pravidlo, kde n = 0, 1, 2 …
-
Myšleným posunem π–elektronů (event. volných elektronových párů) po cyklu musí být možno odvodit alespoň dvě rezonanční struktury.
Typickými aromatickými molekulami jsou také uhlovodíky, které mají dvě a více benzenových jader spojených dohromady společnou stranou, nazývající se kondenzované aromatické uhlovodíky (sousedící kruhy mají vždy dva uhlíkové atomy společné), jako např. naftalen, anthracen a fenanthren.

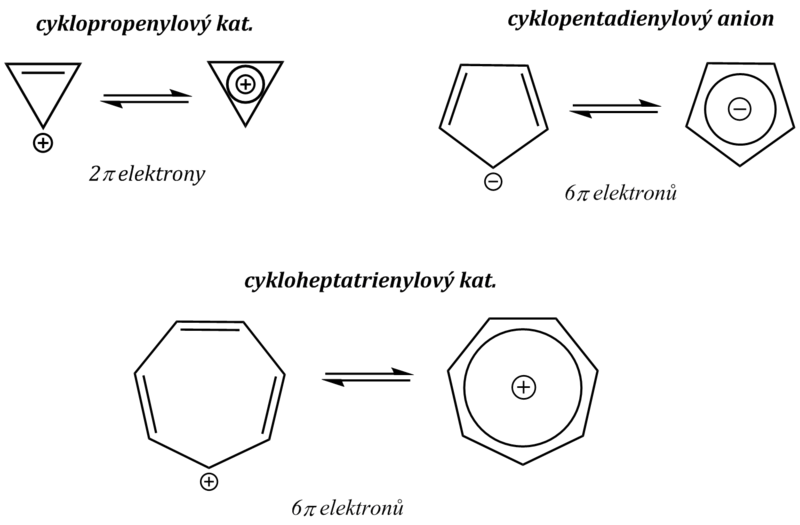
Při dosavadních úvahách jsme se zabývali pouze neutrálními systémy. Je zřejmé, že odtržením, popř. přidáním elektronů do systémů nevyhovujících Hückelovu pravidlu můžeme získat aromatické látky iontové povahy. Příkladem může být nejjednodušší aromatický systém, kterým je cyklopropenylový kation (n = 0, π–elektrony jsou v konjugaci s kladným nábojem). Podobně existuje cykloheptatrienylový kation (n = 1), nebo cyklopentadienylový anion (n = 1).
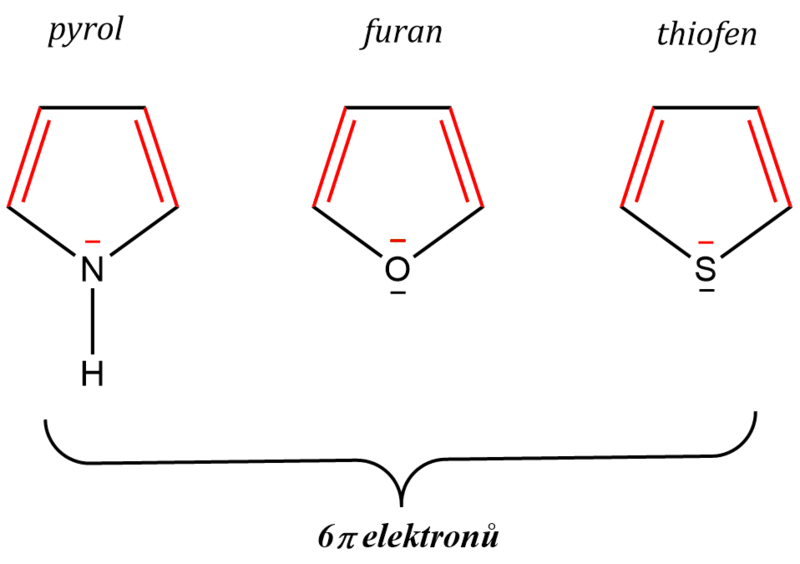
Velkou skupinu aromatických látek tvoří tzv. heterocyklické sloučeniny. Celá řada pětičlenných heterocyklů (jako např. pyrol, furan nebo thiofen, které jsou typickými představiteli těchto látek) vykazuje výraznou aromaticitu. Potřebný počet elektronů pro aromaticitu (4n + 2 = 6) je u nich dán zapojením nevazebného elektronového páru na heteroatomu do delokalizace.