Charakteristika enzymů jako biokatalyzátorů, struktura enzymů
Příroda vyřešila problém zajištění přísunu energie a stavebního materiálu z okolí a jejich využití pro provoz organismu a výstavbu vytvořením složité sítě chemických dějů. Na řízení a koordinaci tohoto systému chemických reakcí a s ním spojených energetických změn se podílí pestrá škála biokatalyzátorů. Jejich nejpočetnější a nejdůležitější skupinu tvoří bílkovinné makromolekuly, které urychlují chemické přeměny a nazývají se enzymy.
Enzymy se nacházejí ve všech živých systémech, i nejjednodušší buňky obsahují přes 3000 enzymů. Každý biologický druh produkuje své vlastní enzymy, které se mohou v některých vlastnostech lišit od enzymů jiného druhu. Počet existujících enzymů se odhaduje na miliardy.
Vlastnosti enzymů:
-
Enzymy umožňují, aby reakce proběhla, nebo ji urychlují.
-
Enzymy umožňují, aby reakce probíhala za mírných podmínek (normální atmosférický tlak, teplota a pH). Obvykle enzymové reakce probíhají při pH blízkém neutrální oblasti (pH 5-7), ale mohou také probíhat při nízkém pH (pepsin: pH 1,5 - 2) nebo vysokém (arginasa: pH 9,5).
-
Enzymy obvykle katalyzují přeměnu jedné látky (nebo skupiny látek) na produkt, případně katalyzují určitý typ chemické reakce.
-
Přítomnost některých látek může ovlivnit enzymovou reakci (urychlit - aktivátor, zpomalit nebo zastavit - inhibitor).
Struktura enzymů
Enzym je vždy složená bílkovina. Má velikou molekulu s Mr mezi 25 000 a několika miliony. Velikostí až na výjimky převyšuje velikost molekuly substrátu.
Bílkovinná část enzymu se nazývá apoenzym, neproteinová část koenzym (kofaktor nebo prostetická skupina). Samotný apoenzym je katalyticky neúčinný, ovšem ani koenzym sám o sobě katalytickou aktivitu neprojevuje.
Kofaktor lze od enzymu oddělit, kdežto prostetická skupina je trvalou součástí enzymu.
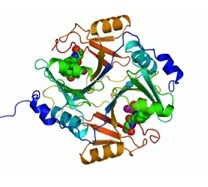
Obr. 1: Obrázek enzymu – lidská glyoxyláza (převažují bílkovinné řetězce, koenzymem jsou ionty zinku – fialové)
Aby byl enzym účinný, musí vytvořit se substrátem enzym-substrátový komplex.
Na povrchu enzymu je relativně malé místo, na které se napojuje substrát. Nazývá se aktivní centrum. Na povrchu enzymu je obvykle jen jedno aktivní centrum. Jde o jakýsi zářez, do kterého zapadne molekula substrátu a zde se naváže. Na této vazbě se uplatňují nevazebné interakce – vodíkové vazby, hydrofobní interakce, elektrostatické síly apod.
Na povrchu enzymu se najdou kromě aktivního centra i determinantní skupiny, čili místa určující imunitní charakteristiku molekuly, nebo mnohá místa vážící jedy a farmaka.
Substrát se navazuje na enzym podle teorie „zámku a klíče“, která byla upravena na teorii indukovaného přizpůsobení. Substrát je do jisté míry schopen vyvolat změnu konformace enzymu, který se tak dokáže přizpůsobit substrátu – tedy tvaru „klíče“. Rovněž tvar substrátu se někdy přizpůsobuje enzymu.
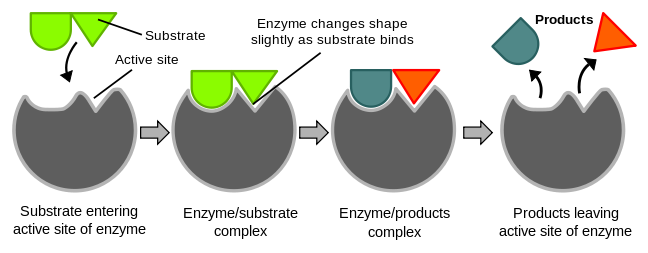
Obr. 2: Schéma indukovaného přizpůsobení
