Elektrochemie
Elektrochemie se zabývá rovnováhami a ději v soustavách, které obsahují částice s elektrickým nábojem.
Poločlánky
 |
|
|
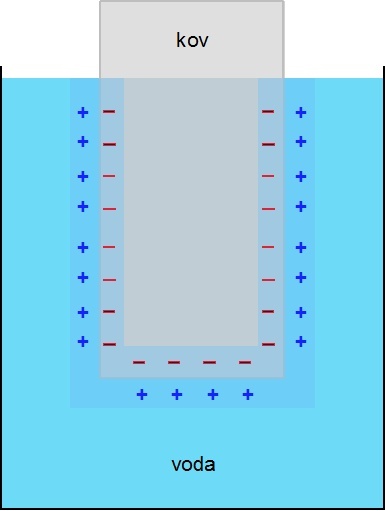
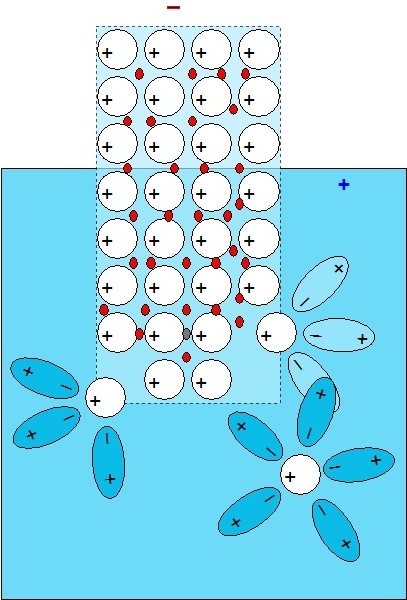 Obr. 2: Hydratace iontů uvolňovaných z krystalové struktury kovu |
||
|
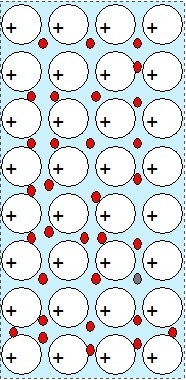
Obr. 1: Krystalová mřížka kovu |
||
|
||
|
Obr. 3: Dynamická rovnováha |
|
|
|
Obr. 4: Poločlánek |
|
Elektrodový potenciál kovu a galvanické články
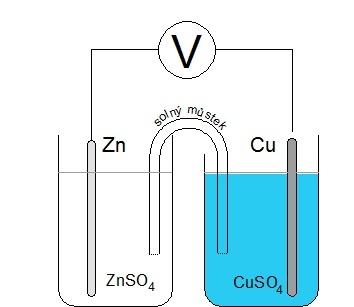
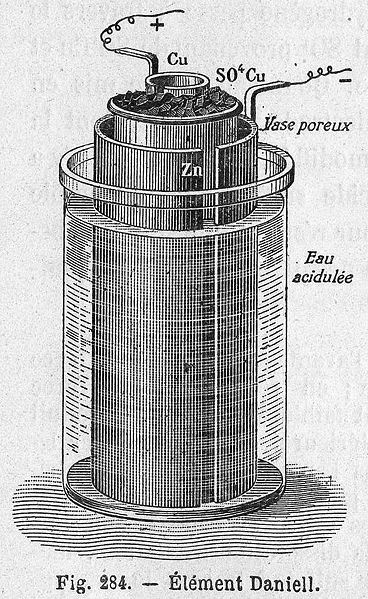
| Potenciál elektrodové dvojvrstvy nelze přímo změřit. Lze však změřit potenciálový rozdíl mezi dvěma poločlánky. Například složením zinkové elektrody v roztoku síranu zinečnatého a měděné elektrody v roztoku síranu měďnatého vznikne tzv. Daniellův článek. Oba poločlánky musí být vodivě propojeny solným můstkem. Solný můstek je tvořen trubicí naplněnou elektrolytem. Konce trubice jsou uzavřeny porézní membránou (nebo smotky buničiny) a ponořeny do roztoků obou poločlánků. Po propojení obou elektrod voltmetrem lze změřit potenciálový rozdíl mezi oběma poločlánky. Pro jednotkové koncentrace obou roztoků solí činí potenciálový rozdíl Daniellova článku 1,1 V. |
Obr. 5: Nákres Daniellova článku |
|
|
Podobně bychom mohli sestavit články s využitím jiných kovů v roztoku jejich iontů. Takovéto články jsou zdrojem elektrického proudu a nazývají se galvanické články. |
| Obr. 6: Daniellův článek | |
| Galvanické články dostaly svůj název podle italského lékaře a fyzika jménem Luigi Galvani (1737–1789), který zjistil, že svaly již mrtvých žab se stahují po dotyku skalpelem. Pohyby svalů vysvětloval působením živočišné elektřiny, kterou svaly vytvářejí. Galvani mylně považoval tuto „živočišnou elektřinu“ za neoddělitelnou vlastnost daného organismu. Jev byl později vysvětlen Alessandrem Voltou jako podráždění nervů ve svalech elektřinou, která vzniká v důsledku reakce kovového skalpelu s kovovou podložkou pracovní plochy. |  |
| Obr. 7: Luigi Galvani |
Standardní redoxní potenciály
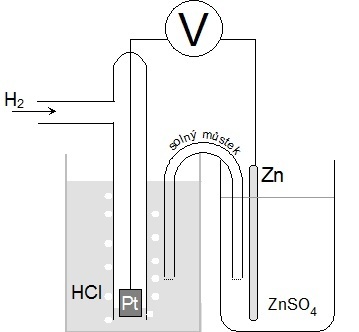
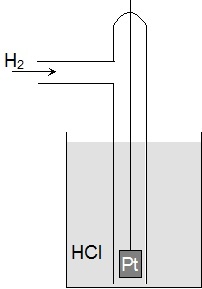
| Nejen pro konstrukci galvanických článků je nutné znát potenciály jednotlivých kovů. Protože absolutní potenciál daného kovu nelze změřit, měří se potenciálový rozdíl mezi poločlánkem tvořeným kovem v roztoku jeho iontů a dohodnutým, přesně definovaným srovnávacím poločlánkem. Srovnávacím poločlánkem je tzv. standardní vodíková elektroda. Standardní vodíková elektroda je platinová elektroda pokrytá platinovou černí, sycená vodíkem pod tlakem 101,325 kPa a ponořená do roztoku HCl o koncentraci 1 mol·dm-3. Je stanoveno, že potenciál standardní vodíkové elektrody je roven 0 V. Podívejte se na foto vodíkové elektrody. |
 |
|
| Obr. 8: Nákres vodíkové elektrody | ||
|
|
Standardní redoxní potenciál Potenciálový rozdíl mezi elektrodou libovolného kovu v roztoku jeho iontů o jednotkové koncentraci při teplotě 25 ºC a standardní vodíkovou elektrodou je definován jako standardní redoxní potenciál kovu a značí se E0. |
|
| Obr. 9: Měření E0 zinkové elektrody |
| Tabulka standardních redoxních potenciálů při teplotě 25 0C | Použití standardních redoxních potenciálů | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Standardní redoxní potenciály E0 jsou vyjadřovány ve voltech (V) a jsou vždy uváděny jako pochody redukční. Pro zinkovou elektrodu značíme standardní elektrodový potenciál Pro měděnou elektrodu značíme standardní elektrodový potenciál
U = E0(Cu2+/Cu) – E0(Zn2+/Zn) = 0,337 V – (–0,763 V) = 1,1 V.
Daniellův článek patří k historicky prvním sestrojeným galvanickým článkům, dnes však nemá praktické uplatnění. |
Voltův sloup
|
Obr. 11: Alessandro Volta
|
Vůbec první galvanický článek sestavil italský fyzik Alessandro Volta (1745–1827). Volta se seznámil s pokusy L. Galvaniho, některé jeho pokusy zopakoval a dokázal, že ke stahování svalů žabích stehýnek nedochází vlivem „živočišné elektřiny“, ale v důsledku dráždění nervů ve svalech elektřinou, která vzniká reakcí kovů ve vodivém prostředí. Elektřinu nazval „elektřinou kovovou“. K důkazu existence této elektřiny použil článek tvořený měděnými a zinkovými kroužky, které proložil kůží namočenou v roztoku soli nebo kyseliny. Tyto články poskládal do série ve tvaru sloupu. Vytvořil tak první dostatečně stálý zdroj elektrického proudu (r. 1799), který byl používán v mnoha laboratořích své doby. Pomocí Voltova sloupu například sir Humphrey Davy rozložil vodu na vodík a kyslík. Volta dál své zařízení zdokonaloval a hledal dvojici kovů, která by ve vodném prostředí poskytovala co největší napětí. |
Obr. 12: Voltův sloup |
Základní pojmy, které v elektrochemii používáme, jsou elektrolyt, elektroda, anoda a katoda.
| Elektrolyt je roztok (nebo také tavenina), který vede elektrický proud. |
| Elektrodou nazýváme elektrický vodič v elektrolytu. |
| Anoda je elektroda, na které dochází k oxidaci. |
| Katoda je elektrody, na které dochází k redukci. |
Hovoříme o "anodické oxidaci" či "katodické redukci".
Leclancheův článek
 |
| Obr. 13: Plochá baterie |

|
| Obr. 14: Monočlánek |
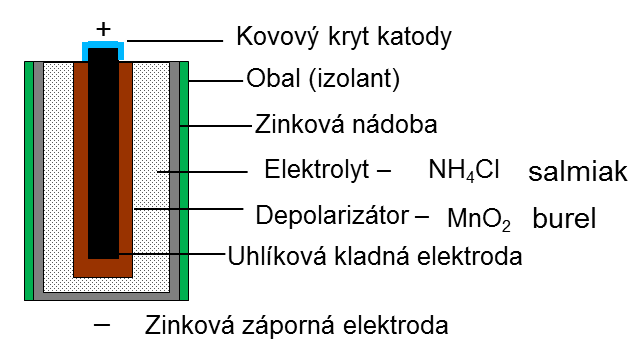 |
| Obr. 15: Schéma suchého článku |
Jedním z nejpoužívanějších galvanických článků je Leclancheův článek, který si nechal v roce 1866 patentovat francouzský inženýr Georges Leclanché. Dnes je používán jako tzv. „suchý článek“ s napětím 1,5 V nebo jako tzv. plochá baterie, která je složena ze tří článků zapojených do série a dosahuje napětí 4,5 V.
Článek je tvořen katodou z uhlíku obklopenou oxidem manganičitým (burelem) a chloridem amonným (salmiakem), který tvoří elektrolyt. Anodu (zde zápornou elektrodu) tvoří zinkový obal celého článku. V Leclancheově článku probíhají tyto chemické reakce:
Na anodě dochází k oxidaci zinku: Zn0 – 2e- → Zn2+ a tím na ní vzniká záporný náboj.
Při vodivém spojení obou elektrod elektrony přecházejí na uhlíkovou katodu, kde redukují kationty amonné:
2 NH4+ + 2e- → 2 NH3 + H2.
Vznikající amoniak se váže do komplexních kationtů se zinečnatými ionty:
Zn2+ + 2 NH3 → [Zn(NH3)2]2+.
Vodík, který by snižoval elektrickou vodivost (zapříčinil by tzv. polarizaci elektrod – článkem protéká menší proud, než odpovídá napětí na elektrodách), je odstraňován reakcí s burelem.
Burel funguje jako depolarizátor: 2 MnO2 + H2 → Mn2O3 + H2O.
Rozlišujeme galvanické články primární a sekundární. Primární články jsou po vybití znehodnoceny a nelze je opakovaně použít. Funkce sekundárních článků neboli akumulátorů je založena na průběhu vratných chemických dějů, a proto je možné článek po vybití znovu nabít a opakovaně použít.
Akumulátory
Olověný akumulátor
|
|
| Obr. 16: Olověný akumulátor v automobilu |
Olověný akumulátor je tvořen deskami ve tvaru mřížky (proto, aby měly co největší povrch), na kterých je nanesena pasta z oxidu olovnatého a kyseliny sírové. Jako elektrolyt se používá kyselina sírová, která je při nabitém akumulátoru asi 37%, což odpovídá hustotě 1,28 g·cm–3.
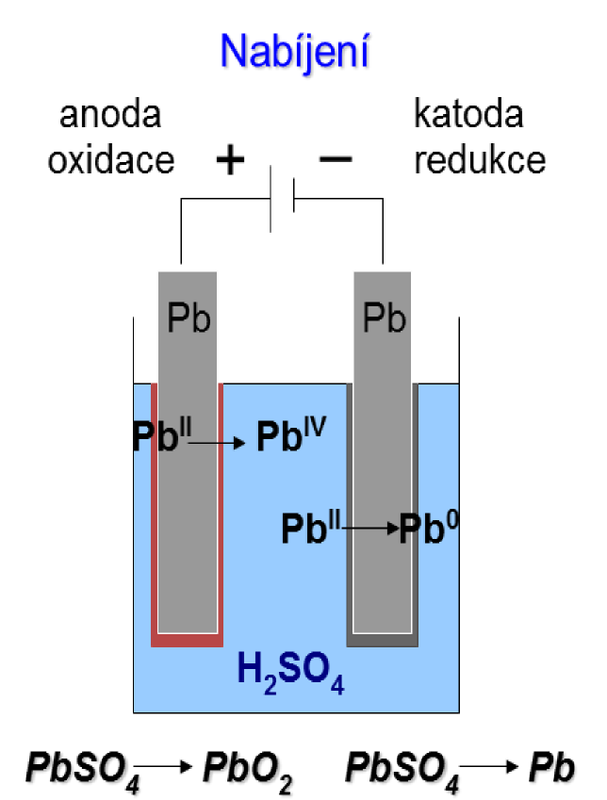
| Při nabíjení akumulátoru se na katodě (zde záporné elektrodě) redukuje síran olovnatý na olovo: PbSO4 + 2e– → Pb0 + SO42– a na anodě (zde kladné elektrodě) se oxiduje síran olovnatý na oxid olovičitý: |
|
| Obr. 17: Schéma nabíjení Pb-akumulátoru | |
|
Při vybíjení akumulátoru dochází na anodě (nyní záporné elektrodě) k oxidaci olova na síran olovnatý: na katodě (nyní kladné elektrodě) k redukci oxidu olovičitého také na síran olovnatý: Při vybíjení se hustota roztoku kyseliny sírové snižuje a při poklesu pod 1,15 g.cm–3 je třeba akumulátor znovu nabít. |
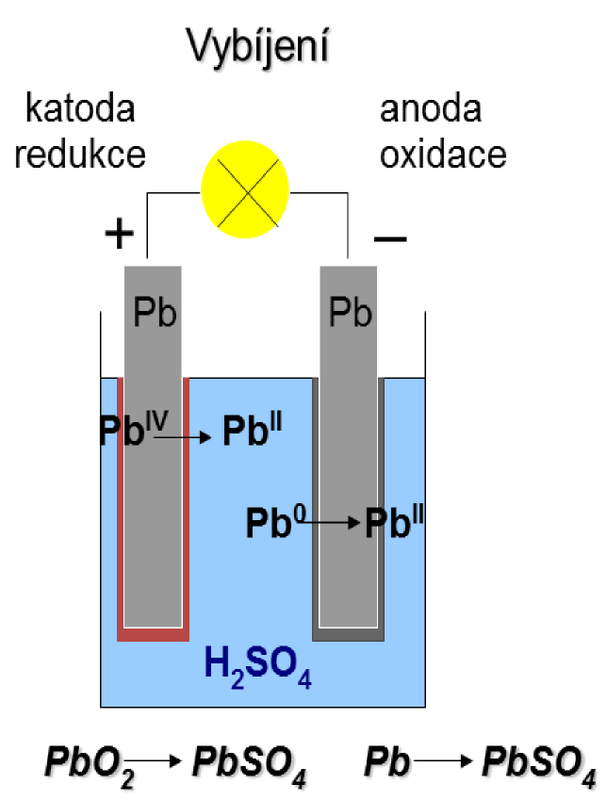 |
| Obr. 18: Schéma vybíjení Pb-akumulátoru | |
| Akumulátor lze opakovaně nabíjet a znovu používat jako zdroj stejnosměrného proudu. | 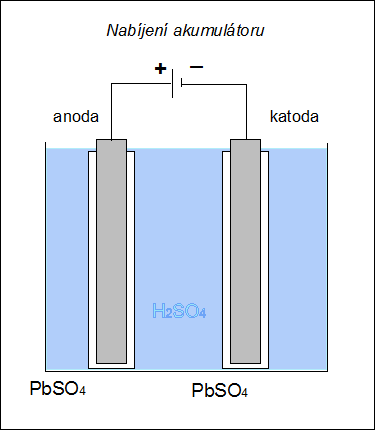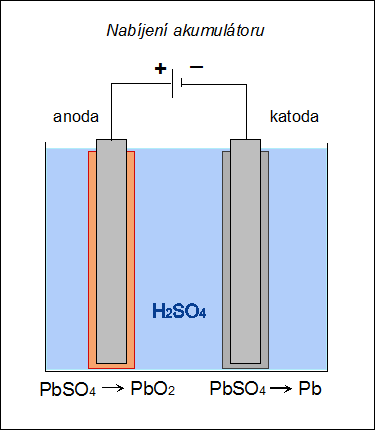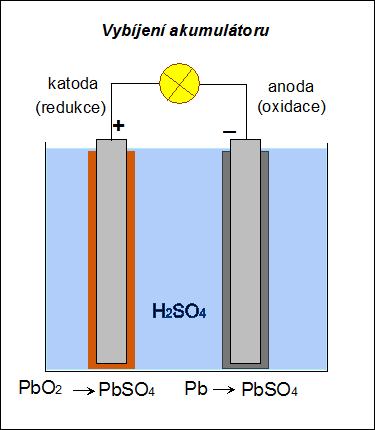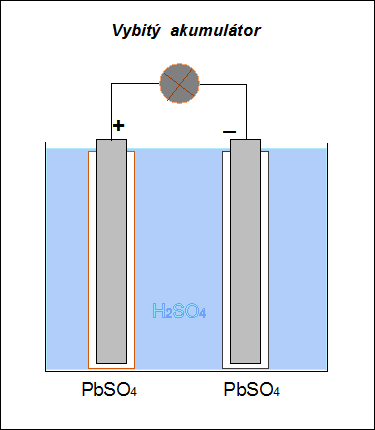 |
| Obr. 19: Animované schéma Pb-akumulátoru |
Jeden olověný článek poskytuje napětí 2 V. Pro použití v automobilech se spojením šesti článků do série dosahuje napětí 12 V.
>>> Pokud je olověný akumulátor ponechán ve vybitém stavu několik dní, dochází k tzv. sulfataci. <<<
Podstatou sulfatace je vytvoření vrstvy krystalického síranu olovnatého na elektrodách, který pak snižuje kapacitu akumulátoru. Krystalický síran olovnatý nepodstupuje tak ochotně reakce, ke kterým má na elektrodách při činnosti akumulátoru docházet, jako síran olovnatý amorfní.
Akumulátor doplňujeme, pokud je nutno, vždy jen destilovanou vodou, nikoli kyselinou!
Pb-akumulátory se používají jako startovací baterie, protože mají malý vnitřní odpor, takže i při vysokých odběrech proudu nedochází k podstatnému úbytku napětí. Je však třeba dávat pozor na nebezpečí zkratu (hrozí požár).
Nikl-kadmiový akumulátor
V nabitém stavu je
kladná elektroda potažená vrstvou oxid-hydroxidu niklitého - NiO(OH),
záporná elektroda je tvořena kadmiem - Cd.
Elektrolyt tvoří vodný roztok hydroxidu draselného KOH.
Při vybíjení probíhá reakce:
Cd + 2NiO(OH) + 2 H2O → Cd(OH)2 + 2 Ni(OH)2,
na záporné elektrodě se oxiduje kadmium (anoda):
Cd + 2 OH− → Cd(OH)2 + 2 e−,
na kladné elektrodě se redukuje nikl z oxidačního stupně III na stupeň II (katoda):
2NiO(OH) + 2 H2O + 2 e− → 2 Ni(OH)2 + 2 OH−.
Při nabíjení probíhá reakce opačná:
Cd(OH)2 + 2 Ni(OH)2 → Cd + 2 NiO(OH) + 2 H2O.
Vlastnosti a použití
 |
| Obr. 20: Akumulátorová vrtačka |
Ni-Cd akumulátory jsou používány pro velmi příznivé vlastnosti s ohledem na poměr hmotnosti ke kapacitě. Výhodou těchto akumulátorů je jejich použitelnost i v extrémních klimatických podmínkách, a to až do –40 °C. Jsou využívány v aplikacích vyžadujících velká proudová zatížení, případně v extrémních klimatických podmínkách. Podstatnou nevýhodou však je, že obsahují vysoce toxické kadmium.
Tyto akumulátory lze skladovat ve vybitém stavu bez ztráty kvality v podstatě libovolnou dobu. Proto jsou prodávány ve vybitém stavu. Před použitím je nutno je nabít.

|
| Obr. 21: Pendolino |
Ni-Cd akumulátory jsou například použity v železničních vozech vlaku Pendolino, kde jsou zdrojem energie pro palubní stejnosměrnou síť o napětí 24 V.
Nikl-metal hydridový akumulátor – NiMH
Tento galvanický článek má zápornou elektrodu tvořenou speciální kovovou slitinou (M), která s vodíkem tvoří směs hydridů (MH). Tuto slitinu tvoří

|
| Obr. 22: NiMH akumulátory |
nejčastěji nikl, kobalt, mangan, hliník, lanthan a některé lanthanoidy (cer, neodym, praseodym). Kladná elektroda je tvořena oxid-hydroxidem niklitým NiO(OH). Jako elektrolyt je použit roztok hydroxidu draselného.
Při vybíjení probíhají reakce:
- Na záporné elektrodě:
MH + OH– → M + H2O + e–
Jak nazvete tuto elektrodu? Je to anoda, či katoda?
- Na kladné elektrodě:
NiO(OH) + H2O + e– → Ni(OH)2 + OH–
Jak nazvete tuto elektrodu? Je to anoda, či katoda?
Celkově lze reakci při vybíjení zapsat: MH + NiO(OH) → M + Ni(OH)2.
Při nabíjení probíhají reakce opačným směrem.
V porovnání s Ni-Cd mají NiMH akumulátory své výhody:
-
NiMH akumulátory mají asi dvojnásobnou kapacitu.
-
Neobsahují toxické kadmium.
-
Mají dlouhou životnost, nízké náklady a možnost rychlonabíjení.
-
Jejich napětí 1,2 V během vybíjení neklesá.
-
Lze je dobíjet při jakémkoliv stavu vybití.
-
Akumulátory s nízkou kapacitou (2000 – 800 mAh) jsou poměrně odolné vůči samovybíjení a jejich životnost představuje asi 1000 nabíjecích cyklů). Čím nižší mají kapacitu, tím delší mají životnost.
Nevýhody:
-
Akumulátory s vysokou kapacitou (2500 – 2700 mAh) podléhají samovybíjení (až 30 % za měsíc při pokojové teplotě).
-
Při nízkých teplotách (pod 5 ºC) přestávají pracovat.
Palivové články
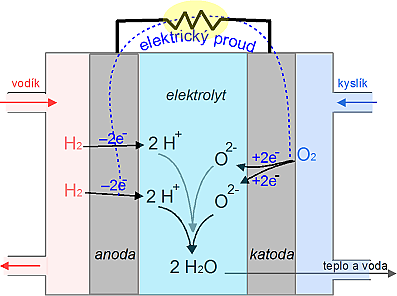
|
| Obr. 23: Schéma palivového článku |
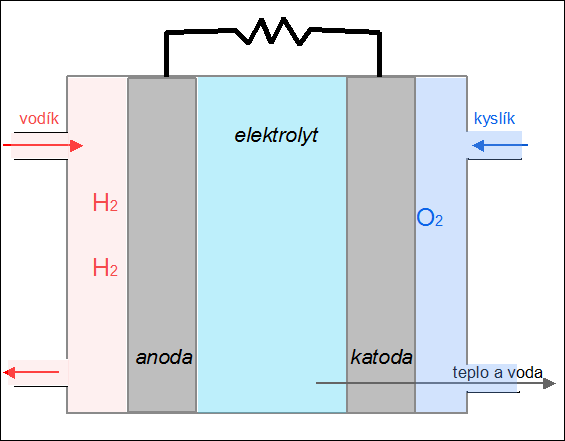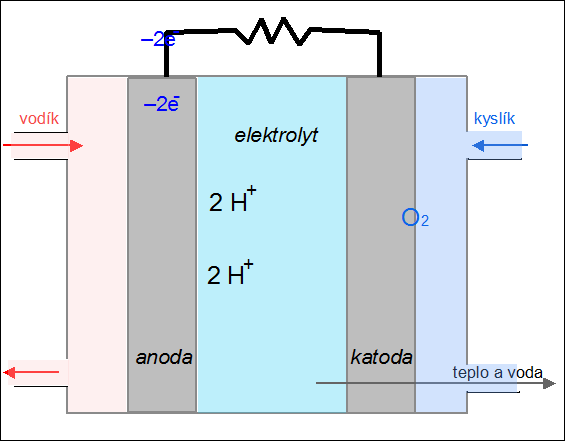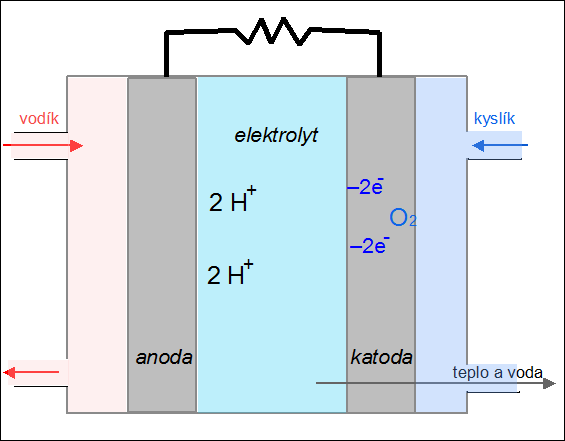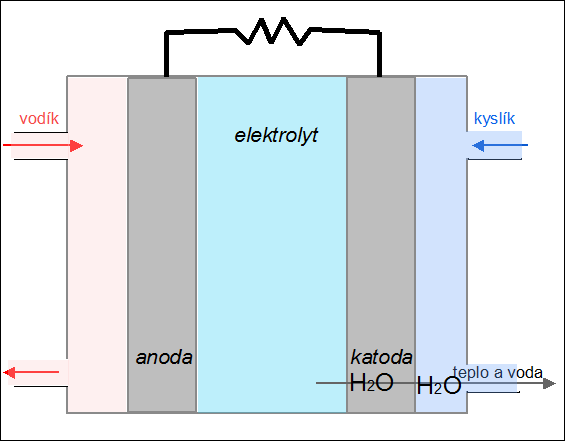 |
| Obr. 24: Animace kyslíko-vodíkového palivového článku |
Palivový článek je zařízení, které převádí chemickou energii paliva na elektřinu. Na rozdíl od akumulátoru se do něj reaktanty neustále přivádějí a produkty reakce kontinuálně odvádějí. Princip fungování palivového článku si ukážeme na kyslíko-vodíkovém článku. Palivem je vodík, který je přiváděn na anodu, kde odevzdává svůj valenční elektron (vodík se oxiduje na H+). Jako okysličovadlo se používá kyslík, který je přiváděn na záporně nabitou elektrodu – katodu, kde se redukuje za vzniku oxidových aniontů O2–. V elektrolytu (např. roztoku KOH) mezi oběma elektrodami dochází k reakci obou iontů za vzniku vody:
2 H+ + O2– → H2O.
Výhodou palivových článků je, že vyrábějí elektřinu přímo z paliva, a dosahují tak účinnosti až 70 %. V klasické uhelné elektrárně je dosahováno účinnosti pouze asi 40 %. K dalším výhodám patří velmi nízké emise škodlivin, malá poruchovost a téměř nehlučný provoz.
K nevýhodám patří technická náročnost a s tím spojené vysoké investiční náklady a také jejich provoz při poměrně vysokých teplotách (řádově stovky stupňů Celsia).
Aplikace
V minulosti byly palivové články použity například v programu Apollo, kde dostaly přednost před jaderným reaktorem. V současné době se začínají stále více uplatňovat. Instalují se jako záložní zdroje energie například v nemocnicích nebo armádních zařízeních. Vyvíjejí se palivové články pro použití v dopravních prostředcích, kde se jeví jako perspektivnější systém pro elektromobily než klasické akumulátory.
Palivem nemusí být pouze vodík, používá se také methanol nebo uhlovodíky.
 |
| Obr. 25: Honda FCX Clarity |
| Zdroj energie: | kyslíko-vodíkové palivové články |
| Dojezd na plnou nádrž vodíku (4,1 kg): | 386 km |
| Výkon motoru: | 100 kW (134 koňských sil) |
| Využívá rekuperační brzdění – energie získaná při brzdění je ukládána ve zvláštních bateriích. | |