Brönsted-Lowryho teorie
Arrhenius považoval za zásady pouze hydroxidy a jeho teorii bylo možné použít jen na vodné roztoky. Proto byla o několik let později navržena nová koncepce – Brönsted-Lowryho teorie kyselin a zásad (častěji uváděna jen jako Brönstedova teorie).
Dánský chemik Johannes Nicolaus Brönsted definoval nezávisle na svém anglickém kolegovi Thomasu Martinovi Lowrym kyseliny a zásady takto:
-
kyselina = částice schopná odštěpit proton H+
Obecně: HA + H2O ⇄ A- + H3O+
Příklad: HCl + H2O ⇄ Cl- + H3O+
-
zásada = částice schopná proton H+ přijmout
Obecně: B + H2O ⇄ BH+ + OH-
Příklad: NH3 + H2O ⇄ NH4+ + OH-
Při protolytických reakcích spolu reaguje kyselina a zásada. Vyměňují si mezi sebou proton ve formě H+:
HA + B ⇄ HB+ + A-
HB+ = Brönstedova kyselina odvozená od zásady B
A- = Brönstedova zásada odvozená od kyseliny HA
Příklad: HCl + NH3 ⇄ NH4+ + Cl-
Společně se zavedením Brönsted-Lowryho teorie je vhodné zavést také pojem konjugovaný pár. Chemickou reakci pak můžeme rozložit na rovnice přeměn dvou konjugovaných párů:
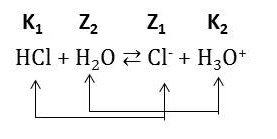
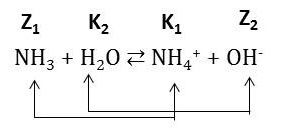
Podle této teorie mohou být kyselinami i zásadami jak ionty, tak elektroneutrální molekuly. Rozhodující je schopnost těchto látek poskytovat nebo přijímat proton.
Některé látky mohou vystupovat jako kyseliny i jako zásady = amfolyty.
Příklad: H2SO4 + 2H2O ⇄ SO42- + 2H3O+
H2SO4 + HClO4 ⇄ ClO4- + H3SO4+
Z první rovnice je zřejmé, že ve vodném prostředí se kyselina sírová chová jako kyselina, ale v prostředí kyseliny chloristé (druhá rovnice) se chová jako zásada. Obdobně se chová např. voda. V prostředí amoniaku se voda chová jako kyselina, ale v prostředí kyseliny chlorovodíkové jako zásada:
H2O + NH3 ⇄ OH- + NH4+
H2O + HCl ⇄ Cl- + H3O+
K předání protonu může dojít i mezi samotnými molekulami protického rozpouštědla. Tento děj se nazývá autoprotolýza.
Příklad: NH3 + NH3 ⇄ NH2- + NH4+
Autoprotolýza vody
Experimentálně bylo zjištěno, že i mezi molekulami vody dochází k její částečné disociaci. Tomuto jevu říkáme autoprotolýza vody:
H2O + H2O ⇄ OH- + H3O+
Z měření vyplynulo, že koncentrace oxonionových kationtů H3O+ je shodná s koncentrací hydroxylových aniontů OH-. Koncentrace obou iontů je při teplotě 25 °C a tlaku 100 kPa rovna asi 10-7 mol.dm-3. Vynásobením koncentrací kationtů H3O+ a aniontů OH- získáme iontový součin vody KW (platný pro danou teplotu a tlak):
KW = [H3O+]•[OH-] = [10-7]•[10-7] = 10-14
