Vlastnosti a reakce halogenderivátů
Fyzikální a vlastnosti
Halogenderiváty se vyskytují ve všech třech skupenstvích v závislosti na molekulové hmotnosti a typu halogenu; teploty tání a varu rostou s protonovým číslem halogenů. Nižší halogenderiváty jsou plynné, s delším řetězcem jsou kapalné, vyšší jsou tuhé. Ve vodě jsou prakticky všechny nerozpustné. Jsou ale dobře rozpustné v tucích a jiných nepolárních organických rozpouštědlech; vstup halogenu vede ke snížení hořlavosti (halogeny jsou “nehořlavé prvky”). Většina halogenderivátů má charakteristický zápach. Chlor - a bromderiváty mají nasládlý zápach, jodderiváty jsou na světle nestálé a hnědnou.
Biologické vlastnosti
Řada z nich má významné biologické účinky, protože mají schopnost procházet různými tělesnými bariérami. Jsou jedovaté, označují se jako kumulativní jedy, protože se ukládají v tkáních, především v tucích. Účinky jsou anestetické, antiseptické, působí jako slzotvorné látky, jsou mezi nimi látky i s karcinogenními účinky. Biologicky aktivní látky jsou např. hormony štítné žlázy (trijódthyronin, tetrajodthyronin = thyroxin).
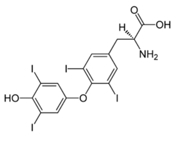
Obr. 1: Vzorec thyroxinu
Chemické vlastnosti
Halogeny jsou elektronegativnější než uhlík (s výjimkou jódu), kovalentní vazba Cδ+ - Xδ- je proto polarizovaná. Vazebné elektrony jsou posunuty směrem k halogenu, který získává parciální záporný náboj. Vzhledem k velikosti elektronegativity je významná polarizace především u vazby C – F a C – Cl. Polarizovatelnost udává snadnost reakcí.
Tab. 1: Porovnání elektronegativit uhlíku, vodíku a halogenů
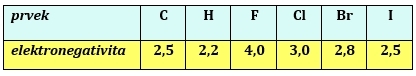
S rostoucím protonovým číslem halogenu (X) roste délka vazby C – X, ale její vazebná energie klesá.
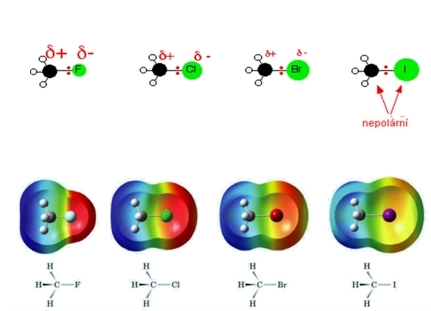
Obr. 2: Rozdělení nábojů v halogenderiátech
Důkaz halogenů
K důkazu se používá Beilsteinova zkouška. Látka se vnese na měděném drátku do plamene. Přítomnost halogenů se projeví zbarvením plamene (zelené, případně modrozelené) vlivem těkavých halogenidů mědi.
Důležité reakce
Poměrně snadno dochází k heterolytickému štěpení vazeb uhlík-halogen. Charakteristická reakce je nukleofilní substituce.
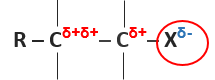
Rozložení parciálních nábojů, reaktivní místa halogenderivátu
Nukleofilní substituce (SNu)
Halogenderiváty reagují s nukleofily za vzniku různých produktů. Při reakci dochází k nahrazení halogenu nukleofilem (-OH, -NH2, -CN). Nejlépe reagují terciární halogenderiváty.
Snadnost tohoto štěpení stoupá v řadě F< Cl < Br < I.
Nejvýznamnější substituční reakce halogenderivátů
Rδ+- Xδ- + Y - → R - Y + X -
vznik alkoholu: R - X + H2O → ROH + HX
vznik alkoholu: R - X + OH - → ROH + X -
vznik etheru: R - X + R´OH → R-O-R´ + HX
vznik aminu: R - X + 2 NH3 → R - NH2 + NH4X
vznik nitrilu: R - X + CN- → R - CN- + X -
Obdobné reakce lze využít i k přípravě uhlovodíků pomocí SNu
R - X + R´- C ≡ CNa → R- C ≡ C - R´ + NaX
R - X + H´ → R - H + X -
R - X + R´- MgX → R - R´ + MgX2
Halogeny jsou substituenty 1.třídy, mají záporný indukční efekt (–I) a kladný mezomerní efekt (+M); další substituce u arenů probíhá do poloh 2 a 4 ( o- a p-). Volný elektronový pár halogenu se zapojuje do konjugace s elektrony aromatického systému a v polohách 2 a 4 se vytváří parciální záporný náboj δ-. Mezomerie působí proti heterolýze vazby C-X. Vzhledem k mezomerii probíhá nukleofilní substituce u aromatických halogenderivátů hůře:
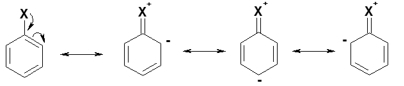
Eliminace E
Je konkurenční reakce substituce. Probíhá účinkem silně bazických nukleofilů (OH-, OR-, H2O, RO-), působením vysoké teploty nebo za přítomnosti Zn. Dochází k současnému odštěpení odstupující skupiny a sousedního protonu (případně dalšího halogenu) za vzniku dvojné vazby a odštěpení halogenu nebo halogenvodíku (X2 nebo HX).
Reakce se řídí Zajcevovým pravidlem- odštěpuje se vodík z uhlíku s menším počtem atomů vodíku (viz 1. rovnice):
CH3 – CH2 – CHBr – CH3 → CH3 – CH = CH – CH3 + HBr
R - CHCl - CHCl - R + Zn → R – CH = CH – R + ZnCl2
ClCH2 – CH2Cl → CH2 = CH – Cl + HCl 500°C
Polymerace
Nenasycené halogenderiváty poskytují polymerací významné produkty, především polyvinylchlorid,Teflon a chloroprenový kaučuk.
n CH2=CHCl → [-CH2-CHCl-]n
vinylchlorid polyvinylchlorid
Mechanismus polymerace - vznik PVC
- Příprava monomeru při teplotě 500°C:
Cl-CH2-CH2- Cl → CH2 = CH2- Cl + HCl
- Vlastní radikálová polymerace:
iniciace: R - R → 2 R `
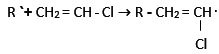
propagace:
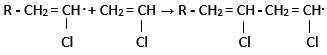
terminace:
Dochází k ukončení makromolekuly, může nastat několika způsoby, například spojením dvou narůstajících řetězců.
Reakce s kovy
Halogenderiváty reagují s některými kovy za vzniku organokovových sloučenin. Elektronegativita je u kovů nižší než u uhlíku a dochází k polarizaci vazby C - kov. Elektrony se posunují od kovu směrem k uhlovodíkovému zbytku. Sloučeniny mají charakter zásad.
Nejvýznamnější jsou tzv. Grignardova činidla. Jedná se o organohořečnaté halogenidy RMgX. R je uhlovodíkový zbytek, X je chlor, brom nebo jod. Vznikají reakcí halogenderivátů s hořčíkem v bezvodém etheru, např.:
C2H5I + Mg → C2H5Mg-I (ethylmagneziumjodid).
Používají se jako alkylační činidla.
Další organokovové sloučeniny slouží jako katalyzátory při syntézách a polymeracích (Zieglerovy) nebo antidetonátory.



