Hydroxykyseliny
Hydroxykyseliny jsou karboxylové kyseliny, které mají v řetězci jeden nebo více atomů vodíku nahrazeny hydroxylovou skupinou.
Názvosloví
Systematický název
Je tvořen názvem výchozí karboxylové kyseliny s příslušným lokantem a předponou hydroxy, případně násobících předpon di, tri. Číslování arabskými číslovkami se používá ve spojení se systematickými názvy kyseliny, označení řeckými písmeny se používá obvykle kombinací s triviálními názvy.
U významnějších hydroxykyselin se používají téměř výhradně triviální názvy.
Vlastnosti
Sirupovité nebo krystalické látky, dobře rozpustné ve vodě a v některých organických rozpouštědlech. Většinou se jedná o kyselejší látky než základní kyseliny a zároveň méně reaktivní a méně kyselé než halogenkyseliny.

Zachovávají si i vlastnosti alkoholů, případně fenolů; dají se oxidovat na oxokyseliny.
Mezi hydroxykyselinami je řada opticky aktivních látek. Této vlastnosti se využívá v analytické chemii v tzv. polarimetrii.

Obr. 1: Tetraedrické modely a Fischerova projekce enantiomerů kyseliny mléčné
Příklady reakcí
Oxidace nebo dehydrogenace
Z primárních a sekundárních hydroxykyselin vznikají oxokyseliny:
HO-CH2-COOH → O=CH-COOH
Zahřívání hydroxykyselin
Dochází k dehydrataci, produkty závisí na umístění OH skupiny:
-
z α- hydroxykyseliny vzniká cyklický diester laktid:

- zahřívání β-hydroxykyselin dochází k eliminaci vody a vznikají nenasycené karboxylové kyseliny:

-
zahříváním γ- a δ- hydroxykyselin vzniká vnitřní ester lakton (1):
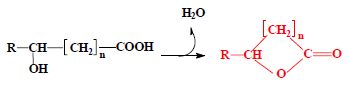
-
hydroxykyseliny s větší vzdáleností hydroxyskupiny tvoří složité polymerní estery.
Příprava hydroxykyselin
α – hydroxykyseliny se připravují hydrolýzou α – halogenkyselin (velmi zředěný roztok hydroxidu), např. příprava kyseliny hydroxyoctové (glykolové):
R-CHCl-COOH + 2 NaOHaq → R-CH(OH)-COONa + NaCl + H2O (vzniká její sůl)
β – hydroxykyseliny se připravují adicí vody na nenasycené karboxylové kyseliny:
CH2=CH-COOH + H2O → CH2(OH)-CH2-COOH
Oxidace diolů nebo hydroxyaldehydů je méně běžná:
HO-CH2-CH2-OH → HO-CH2-CH=O → HO-CH2-COOH
Kyanhydrinová syntéza z aldehydů nebo ketonů, vzniklý nitril se následně hydrolyzuje:

Aromatické hydroxykyseliny lze připravit z příslušného fenolátu za zvýšeného tlaku s oxidem uhličitým, jedná se o tzv. Kolbeho syntézu pro výrobu kyseliny salicylové (2):

Biochemickými procesy za přítomnosti bakterií, případně plísní, vzniká kyselina mléčná, vinná a citronová.
Zástupci
Kyselina glykolová - CH2OH-COOH se vyskytuje v některých cukernatých rostlinách, např. v ananasu, melounu nebo nezralých hroznech. Používá se do přípravků péče o pleť, v kožním lékařství, ale i při organické syntéze.
Kyselina mléčná CH3 – CH(OH) – COOH má asymetrický uhlík a existuje ve 2 enantiomerech. Neaktivní mléčná kyselina vzniká mléčným kvašením cukrů. Je obsažena v kyselém mléku, jogurtech, kefíru, kvašených okurkách, kysaném zelí, a siláži. Pravotočivá mléčná kyselina vzniká ve svalstvu rozkladem glykogenu. Racemická mléčná kyselina je sirupovitá kapalina, snadno rozpustná ve vodě i v ethanolu. Používá se v potravinářském průmyslu, koželužství, textilním průmyslu a v kosmetických přípravcích.
Kyselina jablečná HOOC– CH2 – CH(OH)–COOH chutná trpce, vyskytuje v trpkých a kyselých plodech (zelená jablka), je součástí citrátového cyklu.
Kyselina vinná HOOC– CH(OH) – CH(OH)–COOH je přítomna v hroznech. V přírodě se vyskytuje pouze ve směsi dvou optických izomerů (racemická směs). Hydrogenvínan draselný se sráží na stěnách vinných sudů a tvoří tzv. vinný kámen. Rozpustný vinan draselno-sodný je součástí Fehlingova činidla. Kyselina se používá do nápojových prášků (šumák).
Kyselina citronová HOOCCH2C(OH)(COOH)CH2COOH je krystalická látka, dobře rozpustná ve vodě, v přírodě se vyskytuje v ovoci - citrusové plody, rybíz, brusinky, borůvky. Je součástí Krebsova cyklu. Používá se jako konzervant při zavařování, ochucování v potravinářském průmyslu a jako pomocná látka při výrobě léčiv. Průmyslově se vyrábí biochemicky působením plísně rodu Aspergillius na melasu (vedlejší produkt z výroby sacharózy).
Kyselina gallová , 3,4,5-trihydroxykarboxylová kyselina 
je bezbarvá krystalická látka, ve vodě se rozpouští špatně. Má silné redukční účinky. Patří mezi nejdéle známé kyseliny, protože je obsažena v dubové kůře, listech čajovníku a je i hlavní složkaou taninu. Používá se při výrobě barviv i je součást farmaceutických výrobků (dermatol – zásaditá bismutitá sůl v kožním lékřství, léčba popálenin i střevních chorob).
Kyselina salicylová je bezbarvá krystalická látka, špatně rozpustná ve vodě. Nachází se v kůře vrby. Má velký význam v lékařství.
Kyselina acetylsalicylová je bezbarvá krystalická látka, používá se jako analgetikum, antipyretikum a antiflogistikum.
Kyselina p-aminosalicylová PAS je významný lék proti tuberkulóze.






