Vlastnosti a reakce karbonylových sloučenin
Fyzikální a biologické vlastnosti
Formaldehyd má plynné skupenství (teplota varu -19,3 °C), většina látek je kapalná a nejvyšší karbonylové sloučeniny jsou tuhé. Protože netvoří vodíkové vazby, mají nižší teploty varu a tání než alkoholy. Sloučeniny s kratším řetězcem mají výrazný dráždivý zápach, naopak vyšší se často vyznačují příjemnou vůni (skořice, vanilka, kafr). Rozpustnost ve vodě klesá s počtem C v řetězci, dobře se rozpouštějí v ethanolu a diethyletheru. Některé jsou jedovaté, případně i karcinogenní .
Chemické vlastnosti
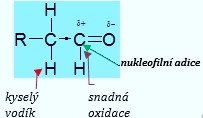
Jedná se o velmi reaktivní látky, reaktivita klesá s počtem uhlíků, obecně jsou nejreaktivnější aldehydy. Karbonylová skupina je polární, π-elektrony se přesunují směrem k elektronegativnějšímu kyslíku a na atomu uhlíku vzniká parciální kladný náboj a na atomu kyslíku parciální záporný náboj: Cδ+ = O δ-. Ovlivňuje i vodíkové atomy navázané na vedlejším uhlíku, zvyšuje jejich kyselost a umožňuje jejich snadnější odštěpení. Skupina má – I efekt a – M efekt (jedná se o substituent 2. třídy).
Významné jsou 3 skupiny reakcí:
-
nukleofilní adice na dvojnou vazbu C=O
-
aldolové kondenzace
-
redoxní reakce
Nukleofilní adice (AdNu)
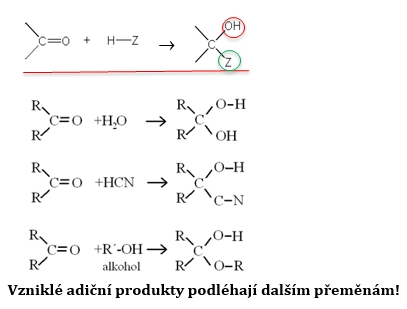
Adice na dvojnou vazbu C = O karbonylu probíhá poměrně snadno, nukleofilní činidlo se váže na uhlík a na kyslík se připojuje proton. Jedná se většinou o vratné reakce, aldehydy jsou reaktivnější než ketony, často jsou adice doprovázeny následnými reakcemi, např. eliminacemi, které stabilizují produkt.
Příklady adičních reakcí

-
adice vody - vzniká nestálý hydrát
-
adice alkoholu- vzniká poloacetal (hemiacetal), v kyselém prostředí acetal
-
adice dusíkatých nukleofilů, např. amoniaku - vzniká hydroxyamin
-
adice kyanovodíku - vzniká hydroxynitril
Redoxní reakce - schéma (1)
Oxidace
Jako oxidační činidla se používají při laboratorních reakcích KMnO4, K2Cr2O7; při průmyslových výrobách kyslík za přítomnosti katalyzátoru.
Pro důkazy aldehydické skupiny s využitím redoxních reakcí se používá Tollensovo (Ag+) a Fehlingovo činidlo (Cu2+).
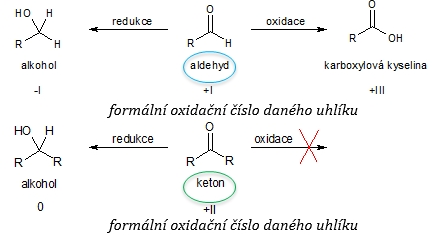
U aldehydů probíhá oxidace snadno za vzniku příslušných karboxylových kyselin:
2 R- CHO + O2 → 2 R - COOH
Ketony oxidaci buď nepodléhají, nebo dochází ke štěpení původního uhlíkového skeletu za vzniku dvou molekul karboxylových kyselin:
CH3CH2COCH2CH3 → CH3COOH + CH3CH2COOH
Redukce
Z aldehydů vznikají primární alkoholy:
R-CHO + H2 → R- CH2OH
Pokud se má zredukovat pouze karbonylová skupina, používá se jako redukční činidlo tetrahydridohlinitan lithný nebo tetrahydridoboritan sodný LiAlH4, NaBH4.
Redukcí ketonů vznikají sekundární alkohol:
CH3COCH3 + H2 → CH3CH(OH)CH3
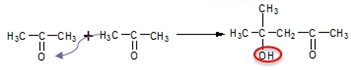
Aldolizace
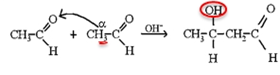
Typická reakce pro aldehydy, které mají na α-uhlíku vodík (kyselý vodík). Probíhá v zásaditém prostředí za chladu, produkt se nazývá aldol (beta-hydroxyaldehyd). Účinkem silné báze se z molekuly karbonylové sloučeniny odštěpí α-vodík a vznikne karbanion, který se sám stává nukleofilním činidlem a aduje se na jinou molekulu karbonylové sloučeniny za vzniku aldolového iontu, který s vodou poskytuje aldol.
V kyselém prostředí dochází k odštěpení vody za vzniku nenasyceného aldehydu.
U ketonů probíhá aldolizace - ketonizace - obtížně.
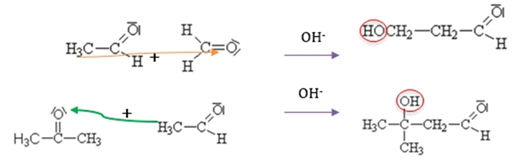
Aldolizace může probíhat i mezi různými karbonylovými sloučeninami, tzv. smíšená aldolizace:
Cannizzarova reakce
Je typická reakce pro aldehydy, které nemají na α-uhlíku vodík. Reakce probíhá v zásaditém prostředí, jedná se o disproporcionační reakci, vzniká kyselina (v zásaditém prostředí její sůl) a alkohol.
pro benzaldehyd:
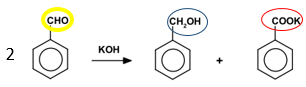
benzaldehyd benzylalkohol benzoan sodný
pro formaldehyd:
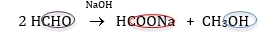
formaldehyd mravenčan sodný methanol
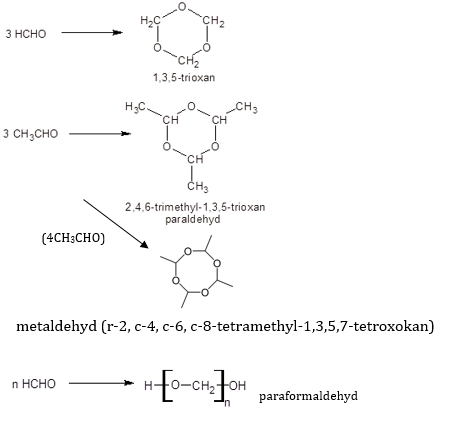
Polymerační reakce
Probíhají poměrně snadno u aldehydů, buď samovolně, nebo katalytickým působením kyselin. Vznikají cyklické nízkomolekulární látky nebo lineární polymery.(2)
Důkazy karbonylových sloučenin
Využívají redukční vlastnosti aldehydů.
Tollensovo činidlo obsahuje komplexní sloučeninu [Ag(NH3)2]OH, která obsahuje Ag+ ionty. Při vzájemné reakci s aldehydy se aldehyd oxiduje na příslušnou kyselinu a Ag+ se redukuje na Ag0. Stříbro se vyloučí za tepla jako stříbrné zrcátko na zkumavce, nebo se ve zkumavce vytvoří houbovité koloidní stříbro:
R – CHO + Ag+ → Ag0 + R-COOH. Tollensovo činidlo s ketony nereaguje.
Fehlingovo činidlo: Fehling I – vodný roztok CuSO4, Fehling II – vodný roztok vínanu draselno-sodného + NaOH. Fehlingovo činidlo vzniká spojením obou roztoků, obsahuje Cu2+ ionty. Při vzájemné reakci s aldehydy se aldehyd oxiduje na příslušnou karboxylovou kyselinu a Cu2+ ionty se redukují na Cu. Měď se projeví jako měděné zrcátko na zkumavce, nebo se ve zkumavce vytvoří houbovitá měď:
R – CHO + 2 Cu2+ → Cu2O + 2H2O + R-COOH. Fehlingovo činidlo s ketony nereaguje.
Schiffovo činidlo obsahuje červený fuchsin odbarvený SO2. Při vzájemné reakci činidla s aldehydy nebo s ketony se SO2 naváže na karbonylovou skupinu a objeví se červené barvivo fuchsin. Z ketonů reagují pouze methylalkylketony a některé cyklické ketony (cyklopentanon, cyklohexanon). (3)
Jodoformová reakce se používá k důkazu acetonu. Aceton s jodem v prostředí hydroxidu sodného reaguje za vzniku jodoformu CHI3. Je to žlutý prášek, s charakteristickým zápachem. Lze ho dokázat Beilsteinovou zkouškou. Vloží-li se jodoform nanesený na měděném drátku do plamene, zbarví se plamen zeleně.



