Uhlík, carboneum, 6C
Uhlík se v přírodě vyskytuje jako čistý prvek ve formě diamantu nebo grafitu (tuhy). Vázaný je součástí oxidu uhličitého CO2, který je ve vzduchu a minerálních vodách; nerozpustných uhličitanů: vápenec (kalcit, aragonit) CaCO3, magnezit MgCO3, dolomit CaCO3 ∙ MgCO3, siderit (ocelek) FeCO3; fosilních paliv (uhlí, ropa, zemní plyn). Uhlík je základní biogenní prvek, tvoří základ většiny organických sloučenin. V nich se uhlík spojuje do nejrůznějších řetězců , a proto je organických sloučenin mnohem více než tvoří všechny ostatní prvky dohromady. Těmito sloučeninami se zabývá samostatná chemická disciplína, tzv. organická chemie.
Izotopy uhlíku jsou tři: 98,9% je 12C, další jsou 13C a 14C (radioaktivní).
Diamanty lze vyrobit z grafitu za vysokých teplot a obrovských tlaků. V posledních třiceti letech byly objeveny nebo vyrobeny další modifikace uhlíku jako např. fullereny, grafen či uhlíkové nanotrubice. Tepelným rozkladem organických sloučenin za nepřístupu vzduchu lze vyrobit další formy čistého uhlíku - koks, saze, živočišné uhlí, aktivní uhlí.
Vlastnosti
Vlastnosti diamantu a grafitu jsou přehledně uvedeny v následující tabulce:
|
Diamant |
Grafit |
|
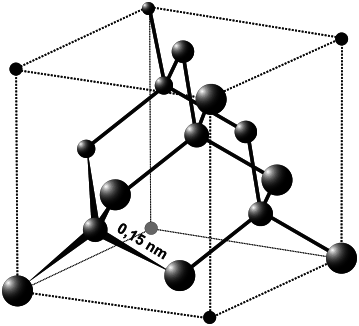
krystaluje v krychlové soustavě
Obr. 1: Struktura diamantu
|
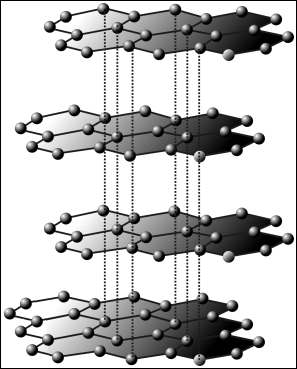
krystaluje v šesterečné soustavě
Obr. 2: Struktura grafitu |
|
nejtvrdší nerost |
měkký |
|
bezbarvý |
šedočerný, kovově lesklý |
|
čirý, průhledný |
neprůhledný |
|
nevede teplo a elektrický proud |
vede teplo a elektrický proud |
Všechny modifikace uhlíku jsou málo reaktivní, reagují až za vysoké teploty:
C + 2 F2 → CF4
Všechny modifikace včetně grafitu a diamantu na vzduchu hoří:
2 C + O2 → 2 CO při nedostatku kyslíku
C + O2 → CO2 za dostatečného přístupu kyslíku
Uhlík má redukční účinky:
C + 4 HNO3 → CO2 + 4 NO2 + 2 H2O
C + 2 H2SO4 → CO2 + 2 SO2 + 2 H2O
Fe2O3 + 3 C → 3 CO + 2 Fe
Jako jediný prvek má schopnost tvořit řetězce uhlíkových atomů spojených jednoduchou, dvojnou nebo trojnou vazbou (organické sloučeniny).
Použití
Diamanty čiré a průhledné se brousí nejčastěji do tvaru briliantu a využívají se v klenotnictví. Ostatní diamanty, tzv. technické, se používají jako nože na řezání skla, k opracovávání tvrdých materiálů, jako hlavice vrtných souprav nebo ložiska přesných přístrojů.
Grafit se používá k výrobě tužek, elektrod a tavících kelímků, jako mazadlo ložisek, moderátor (zpomalovač neutronů) v jaderných reaktorech.
Koks má využití jako palivo, k redukci kovů z rud (Fe, Sn, Ni, Zn), k výrobě vodíku, fosforu, křemíku.
Aktivní uhlí má velký povrch, a proto schopnost adsorpce plynů (např. v plynových maskách) i jiných látek (např.živočišné uhlí).
Fullereny a uhlíkové nanotrubice mají využití v nanotechnologiích, grafen v elektronických a optických aplikacích.

Obr. 3: Fulleren C60
Sloučeniny uhlíku
Karbidy jsou binární sloučeniny uhlíku s kovy, borem a křemíkem.
Karbid vápenatý CaC2 se vyrábí z oxidu vápenatého a koksu za vysoké teploty:
CaO + 3 C → CaC2 + CO
Reaguje s vodou za vzniku acetylenu:
CaC2 + 2 H2O → C2H2 + Ca(OH)2
Karbid křemičitý SiC lze obdobně vyrobit z oxidu křemičitého:
SiO2 + 3 C → SiC + 2 CO
Je tvrdý, ale méně než diamant. Nereaguje s vodou. Používá se jako brusivo (karborundum, brusný papír).
Uhlovodíky jsou sloučeniny uhlíku s vodíkem a podobně jako všechny organické sloučeniny jsou předmětem studia organické chemie.
Chlorid uhličitý (tetrachlormethan) CCl4 se používá jako nepolární rozpouštědlo organických látek a do hasicích přístrojů. Nesmí se však používat při hašení v uzavřené místnosti, protože vzniká jedovatý plyn fosgen COCl2.
Sirouhlík CS2 je jedovatá bezbarvá hořlavá kapalina. Vyrábí se přímou syntézou:
C + 2 S → CS2
Používá se jako nepolární rozpouštědlo.
Kyanovodík HCN je prudce jedovatý plyn (váže se nevratně na železo v hemoglobinu a zabraňuje tomu, aby se vázal kyslík). Je rozpustný ve vodě:
HCN + H2O ⇆ H3O+ + CN–
Vzniklá kyselina je velmi slabá, její soli kyanidy jsou rovněž prudké jedy:
CN– + H2O ⇆ HCN + OH–
Kyanid draselný KCN je známý jed cyankali.
Oxid uhelnatý CO je obsažen ve výfukových plynech motorových vozidel. Vzniká nedokonalým spalováním uhlíku (při nedostatku kyslíku):
2 C + O2 → 2 CO
Vzniká také při redukci oxidů uhlíkem za vysokých teplot.
Je to bezbarvý, velmi jedovatý plyn (váže se nevratně na železo v hemoglobinu), je bez zápachu a velmi reaktivní. Má redukční účinky, kterých se využívá při výrobě železa ve vysokých pecích:
3 Fe2O3 + CO → CO2 + 2 Fe3O4
Fe3O4 + CO → CO2 + 3 FeO
FeO + CO → CO2 + Fe
Je nerozpustný ve vodě, nereaguje s vodou ani s kyselinami a hydroxidy. Používá se k redukci kovů z rud a jako průmyslové palivo: generátorový plyn (směs CO + N2 + CO2) nebo vodní plyn (směs CO + H2).
Oxid uhličitý CO2 je výchozí látkou pro fotosyntézu, která probíhá v zelených částech rostlin působením sluneční energie. Reakci katalyzuje chlorofyl:
6 CO2 + 6 H2O → C6H12O6 + 6 O2
Rovněž je produktem oxidace organických látek v organismu.
Vyskytuje se ve vzduchu (0,03%) a je obsažen v krvi. Připravit lze vytěsněním z uhličitanů:
CaCO3 + 2 HCl → CO2 + CaCl2 + H2O
Vyrábí se:
1. Vymrazováním vzduchu před jeho frakční destilací
2. Pálením vápence:
CaCO3 → CO2 + CaO
3. Přímou syntézou – hořením uhlíku:
C + O2 → CO2
4. Z methanu a vodní páry:
CH4 + 2 H2O (g) → CO2 + 4 H2O
Oxid uhličitý je bezbarvý plyn slabě kyselé chuti, není jedovatý, ale je nedýchatelný. Má větší hustotu než vzduch, dá se zkapalnit a ztužit (suchý led). Tuhý sublimuje při teplotách vyšších než –78 °C. Je málo reaktivní, reaguje s vodou tak, že vzniká slabě kyselý roztok:
CO2 + 2 H2O ⇆ H3O+ + HCO3–
Přepravuje se v ocelových lahvích s černým pruhem. Používá se do hasících přístrojů a k výrobě nealkoholických nápojů. Kapalným se odstraňují tuky z potravin a kofein z kávy. Pevný (suchý led) se využívá k chlazení.
Kyselina uhličitá H2CO3 existuje pouze ve zředěném vodném roztoku. Je to velmi slabá dvojsytná kyselina, která tvoří dvě řady solí – uhličitany a hydrogenuhličitany.
Hydrogenuhličitany jsou sloučeniny obsahující anion HCO3– . Jsou rozpustné ve vodě, způsobují přechodnou tvrdost vody (hydrogenuhličitany vápenatý a hořečnatý). Tepelným rozkladem hydrogenuhličitanů alkalických kovů vznikají uhličitany:
2 NaHCO3 → Na2CO3 + CO2 + H2O
Hydrogenuhličitan sodný (jedlá soda) NaHCO3 se používá v potravinářství (do kypřících prášků do pečiva) a lékařství (proti pálení žáhy).
Uhličitany jsou sloučeniny s aniontem CO3 2– . Jsou nerozpustné ve vodě (kromě Na2CO3, K2CO3). Zahříváním se rozkládají:
CuCO3 → CuO + CO2
Rozložit je můžeme i působením kyselin. V přírodě tak vznikají krasové jevy. Působením slabé kyseliny uhličité se rozpouští ve vodě jinak nerozpustný vápenec CaCO3. Zpětná reakce zase vystihuje vznik krápníků v jeskyních.
CaCO3 + CO2 + H2O ⇆ Ca(HCO3)2
Uhličitan sodný (soda) Na2CO3 se vyrábí Solvayovou metodou:
NaCl + NH3 + CO2 + H2O → NaHCO3 + NH4Cl
2 NaHCO3 → Na2CO3 + H2O + CO2
Používá se k odstraňování tvrdosti vody a k výrobě sodných solí, skla a mýdla.
Dekahydrát uhličitanu sodného Na2CO3 ∙ 10 H2O se nazývá krystalová soda.
Uhličitan draselný (potaš) K2CO3 má podobné využití jako soda – k výrobě skla a mýdel.
Uhličitan vápenatý CaCO3 tvoří dva minerály: aragonit (krystaluje v kosočtverečné soustavě) a kalcit (krystaluje v klencové soustavě). Dále lze jako uhličitan vápenatý označit vápenec (kalcit s příměsemi), křídu (jemnozrnný kalcit vzniklý z vápenatých schránek drobných živočichů), mramor a travertin.
Ve stavebnictví se používá pálené vápno, které se vyrábí pálením vápence ve vápenkách:
CaCO3 → CaO + CO2
Mramor se používá jako dekorativní kámen.