Vlastnosti fenolů
Fenoly jsou pevné krystalické látky, výjimkou je kapalný m-kresol (teplota tání 11,8 °C). Protože tvoří vodíkové vazby, mají vyšší teplotu varu, než odpovídá jejich molární hmotnosti. Ve vodě jsou špatně rozpustné, ale dobře se rozpouštějí v etheru a ethanolu. Samotný fenol je hygroskopický, částečně rozpustný ve vodě, rozpustnost obecně roste s počtem hydroxyskupin. Velmi dobře se rozpouštějí v roztocích hydroxidů alkalických kovů, přitom ale vznikají fenoláty. Mají charakteristický zápach „dezinfekce“. Čisté fenoly jsou bezbarvé, na vzduchu se poměrně rychle barví do červena, fialova až hněda.
Vyznačují se významnými biologickými účinky, jsou zdraví škodlivé, některé jsou i toxické nebo karcinogenní, často mají antiseptické a impregnační účinky.
Reakce fenolů
Chování fenolů ovlivňuje přítomnost – OH skupiny, jejich počet a aromatický charakter. Hydroxyskupina je substituent 1.třídy (má kladný mezomerní efekt), aktivuje do polohy o- a p-. Vodík v - OH skupině je kyselý, má parciální kladný náboj. Fenoly jsou silnějšími kyselinami než alkoholy, se zásadami tvoří fenoláty. Fenolátový ion je stabilizován mezomerií. Kyselost fenolů ovlivňuje přítomnost dalších substituentů; kyselost se zvyšuje přítomností elektronegativního substituentu, jako je – NO2, -Cl, -CN, -COOH. Kyselina pikrová, 2,4,6-trinitrofenol, je vlivem –M efektu nitroskupiny kyselejší než většina karboxylových kyselin.
Substituenty 1. třídy vedou naopak k poklesu kyselosti, např. –NH2, -CH3, halogeny.
Vznik fenolátů
Vůči zásadám se chovají jako kyseliny, jsou silnějšími kyselinami než alkoholy (kladný mezomerní efekt +M efekt); na rozdíl od alkoholů se dají neutralizovat roztoky silných hydroxidů za vzniku fenolátů:
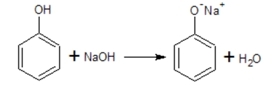
Vznik fenolátu sodného (natrium-fenolát)
Oxidace
Podle síly oxidačního činidla a podmínek mohou vznikat buď dvojsytné fenoly (slabá oxidace) nebo chinony (silná oxidace). Dvojsytné fenoly pyrokatechol a hydrochinon se oxidují snadno na příslušný chinon.
Slabá oxidace probíhá působením například peroxidu vodíku v přítomnosti železnatých solí a vzniká směs dvojsytných fenolů:
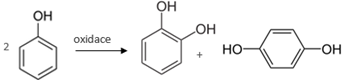
pyrokatechol hydrochinon
Silnější oxidace probíhá za vyšší teploty a silnějších oxidačních činidel (kyselina dusičná) a vzniká směs chinonů.
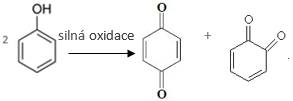
p-benzochinon o-benzochinon
Snadno vznikají chinony oxidací dvojsytných fenolů Tollensovým činidlem, reakci lze využít k jejich rozlišení a důkazu.
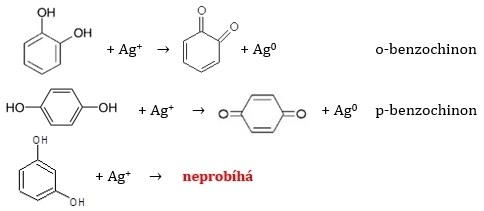
Oxidace fenolů
Elektrofilní aromatická substituce
Reakce vlivem přítomnosti hydroxyskupiny (+M efekt) probíhají mnohem snadněji, například nitrace, halogenace, sulfonace.
Nitrace
Působením nitrační směsi lze provádět nitraci postupně až do 3. stupně, konečným produktem nitrace fenolu do 3. stupně je kyselina pikrová. Při nitraci fenolu do 1. stupně vzniká směs o-nitrofenolu (40%) a p-nitrofenolu (13%), lze je od sebe oddělit destilací vodní parou (oddestiluje o-nitrofenol). Při nitraci naftolu vstupuje další nitroskupina do jádra aktivovaného hydroxyskupinou za vzniku dvou derivátů a to 2-nitro-1-naftolu a 4-nitro-1-naftolu.
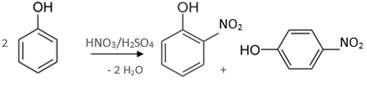
Nitrace fenolu nitrační směsí
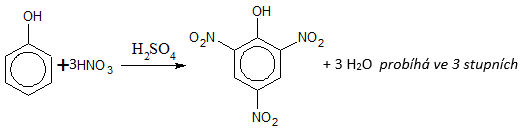
Příprava kyseliny pikrové
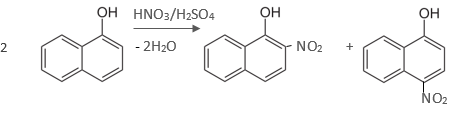
Nitrace naftolu
Bromace
Reakce probíhá snadno a to i přímo (podle podmínek) do 3. stupně s vodným roztokem bromu v alkalickém prostředí, vyloučení bílé sraženiny 2, 4, 6 –tribromfenolu je důkazem fenolu.
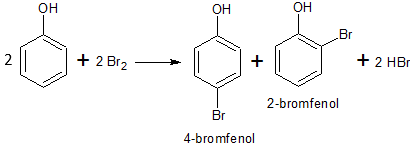
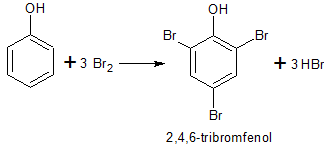
Bromace fenolu
Hydrogenace
Za přítomnosti katalyzátorů vznikají cyklické alkoholy (kat Ni, Pd); např. hydrogenací fenolu se průmyslově získává cyklohexanol.
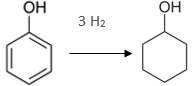
Kolbe-Schmittova reakce
Fenol reaguje s oxidem uhličitým za vysokého tlaku a za přítomnosti nadbytku hydroxidu sodného (reakce fenolátu) za vzniku disodné soli kyseliny salicylové; k uvolnění kyseliny se používá vytěsnění kyselinou sírovou.
Příprava kyseliny salicylové (1)
Kondenzační rekce fenolů
Fenolformaldehydové pryskyřice - fenoplasty
Výroba fenoplastů probíhá v slabě kyselém i zásaditém prostředí. Produkty (fenolformaldehydové pryskyřice) se liší podle poměru výchozích látek a použitého pH.

Vznik fenoplastu (fenolformaldehydové pryskyřice) (2)
Bisfenol A
Kondenzační reakcí fenolu s acetonem v kyselém prostředí vzniká významná výchozí látka pro výrobu epoxidových pryskyřic tzv. Dian = Bis fenol A [2,2bis(hydroxyfenyl)propan; správněji propan-2,2-diyldifenol].(3)
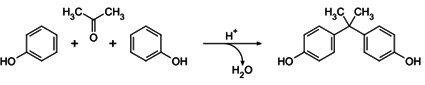
Příprava Bisfenolu A (3)
Reakce fenolů s chloridem železitým
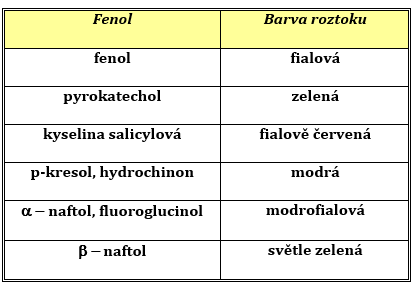
Roztoky fenolů s roztokem chloridu železitého tvoří charakteristické různobarevné roztoky, které je možno využít při důkazu těchto látek.
Tab. 1: Zabarvení roztoků fenolů s chloridem železitým